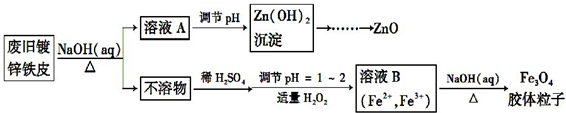
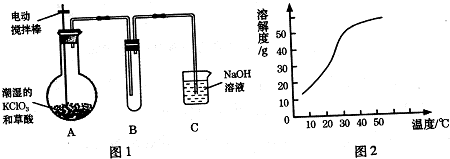
题目内容
12.A、B、C、D是原子序数均小于20的四种元素,A与B同主族,既能形成BA2型分子又能形成BA3型分子.B、C、D所形成的简单离子电子层结构相同,且B、C、D离子半径依次减小.据此回答下列问题:
(1)C元素在元素周期表中的位置是第三周期VIIA族.
(2)B与D所形成的化合物电子式为
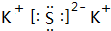 .
.(3)将C单质和BA2同时通入水中,会生成两种强酸,其反应的离子方程式为Cl2+SO2+2H2O=4H++2Cl-+SO42-.
(4)实验室里除去BA2气体,可用下列试剂中的AC(填字母).
A.酸性高锰酸钾溶液 B.浓H2SO4 C.NaOH溶液 D.品红溶液
(5)由A、B、D三种元素所组成的某种盐溶液在空气易被氧化而变质,其原因是(用离子方程式表示)2SO32-+O2═2SO42-.
分析 A、B、C、D是原子序数均小于20的四种元素,A与B同主族,既能形成BA2型分子又能形成BA3型分子,B元素化合价有+4价、+6价,S、O元素符合条件,则B是S元素、A是O元素;
B、C、D所形成的简单离子电子层结构相同,且B、C、D离子半径依次减小,则C是Cl元素、D是K元素,
(1)C是Cl元素,原子核外电子层数与其周期数相等、主族元素最外层电子数与其族序数相等;
(2)B、D分别是S、K元素,二者形成离子化合物硫化钾;
(3)氯气具有强氧化性,二氧化硫具有还原性,二者在水溶液中发生氧化还原反应生成硫酸和盐酸;
(4)二氧化硫具有还原性,能被强氧化剂氧化生成硫酸;二氧化硫属于酸性氧化物,能和碱溶液反应生成盐;
(5)由A、B、D三种元素所组成的某种盐溶液在空气易被氧化而变质,为物质为亚硫酸钾,亚硫酸钾被氧气氧化生成硫酸钾.
解答 解:A、B、C、D是原子序数均小于20的四种元素,A与B同主族,既能形成BA2型分子又能形成BA3型分子,B元素化合价有+4价、+6价,S、O元素符合条件,则B是S元素、A是O元素;
B、C、D所形成的简单离子电子层结构相同,且B、C、D离子半径依次减小,则C是Cl元素、D是K元素,
(1)C是Cl元素,原子核外电子层数与其周期数相等、主族元素最外层电子数与其族序数相等,Cl原子核外有3个电子层、最外层有7个电子,所以位于第三周期第VIIA族,故答案为:第三周期VIIA族;
(2)B、D分别是S、K元素,二者形成离子化合物硫化钾,电子式为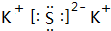 ,故答案为:
,故答案为: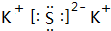 ;
;
(3)氯气具有强氧化性,二氧化硫具有还原性,二者在水溶液中发生氧化还原反应生成硫酸和盐酸,离子方程式为Cl2+SO2+2H2O=4H++2Cl-+SO42-,故答案为:Cl2+SO2+2H2O=4H++2Cl-+SO42-;
(4)二氧化硫具有还原性,能被强氧化剂氧化生成硫酸;二氧化硫属于酸性氧化物,能和碱溶液反应生成盐,酸性高锰酸钾具有强氧化性、烧碱溶液具有碱性,所以可以用酸性高锰酸钾溶液、氢氧化钠溶液吸收二氧化硫,故选AC;
(5)由A、B、D三种元素所组成的某种盐溶液在空气易被氧化而变质,为物质为亚硫酸钾,亚硫酸钾被氧气氧化生成硫酸钾,离子方程式为2SO32-+O2═2SO42-,故答案为:2SO32-+O2═2SO42-.
点评 本题考查位置结构性质相互关系及应用,正确判断元素是解本题关键,涉及氧化还原反应、除杂、电子式的书写等知识点,综合性较强,注意二氧化硫和氯气以1:1通入水中所得溶液没有漂白性,为易错点.

 阅读快车系列答案
阅读快车系列答案| A. | Al3+Na+HCO3- Cl- | B. | K+ Na+ HCO3-AlO2- | ||
| C. | Mg2+ NH4+ SO42-Cl- | D. | Fe2+ Na+Cl- NO3- |
| A. | Al(OH)3 | B. | Al2O3 | C. | H2SiO3 | D. | MgCO3 |
| A. | CH4、C2H4 | B. | CH4、C2H5OH | C. | C2H6、C3H8 | D. | CH3CHO、C3H8 |
| A. | 氢键比范德华力强,所以它属于化学键 | |
| B. | H2O是一种非常稳定的化合物,这是由于氢键所致 | |
| C. | 含氢原子的物质之间均可形成氢键 | |
| D. | 分子间形成的氢键使物质的熔点和沸点升高 |
| A. | 钠与水反应:Na+H2O=Na++OH-+H2↑ | |
| B. | 铝与盐酸反应:2Al+6H+=2Al3++3H2↑ | |
| C. | 氢氧化铝与盐酸反应:OH-+H+=H2O | |
| D. | 氯化铝与氨水反应:Al3++3OH-=Al(OH)3↓ |

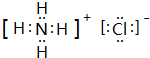 .
.