15.资料显示:a.Na2S2O3、BaS2O3、BaS均易溶于水.
b.SO2、Na2S、Na2CO3反应可生成Na2S2O3.
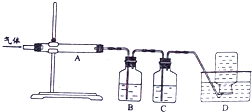
某化学小组据此进行了制备硫代硫酸钠晶体(Na2S2O3•5H2O)的探究.实验制备装置如图所示(省略夹持装置):

回答问题:
(1)仪器a的名称是分液漏斗.
(2)装置B的作用之一是观察SO2的生成速率.B中最好盛装的液体是c.
a.蒸馏水 b.饱和Na2SO3溶液 c.饱和NaHSO3溶液 d.饱和NaHCO3溶液
(3)在装置C中生成Na2S2O3.
①完成反应方程式:4SO2+2Na2S+1Na2CO3=3Na2S2O3+CO2
②反应开始先使A中发生反应一会儿,再使C中反应发生,其原因是排除装置内空气,防止发生氧化生成Na2SO4.
③结束反应后,取C中溶液,经蒸发浓缩、冷却结晶、过滤、洗涤、干燥、得到Na2S2O3•5H2O.
(4)完成对所得产品的检测的实验:
(5)硫代硫酸钠(Na2S2O3)是常用的还原剂.在维生素C(化学式C6H8O6)的水溶液中加入过量I2溶液,使维生素C完全氧化,剩余的I2用Na2S2O3溶液滴定,可测定溶液中维生素C的含量.发生的反应为:
C6H8O6+I2═C6H6O6+2H++2I- 2S2O32-+I2═S4O62-+2I-
在一定体积的某维生素C溶液中加入a mol•L-1I2溶液V1mL,充分反应后,用Na2S2O3溶液滴定剩余的I2.上述滴定时,采用淀粉作指示剂,判断滴定终点的现象是滴加最后一滴Na2S2O3标准液时溶液由蓝色变为无色且半分钟内不变色.消耗b mol•L-1Na2S2O3溶液V2mL.该溶液中维生素C的物质的量是(aV1-$\frac{b{V}_{2}}{2}$)×10-3mol.
b.SO2、Na2S、Na2CO3反应可生成Na2S2O3.
某化学小组据此进行了制备硫代硫酸钠晶体(Na2S2O3•5H2O)的探究.实验制备装置如图所示(省略夹持装置):

回答问题:
(1)仪器a的名称是分液漏斗.
(2)装置B的作用之一是观察SO2的生成速率.B中最好盛装的液体是c.
a.蒸馏水 b.饱和Na2SO3溶液 c.饱和NaHSO3溶液 d.饱和NaHCO3溶液
(3)在装置C中生成Na2S2O3.
①完成反应方程式:4SO2+2Na2S+1Na2CO3=3Na2S2O3+CO2
②反应开始先使A中发生反应一会儿,再使C中反应发生,其原因是排除装置内空气,防止发生氧化生成Na2SO4.
③结束反应后,取C中溶液,经蒸发浓缩、冷却结晶、过滤、洗涤、干燥、得到Na2S2O3•5H2O.
(4)完成对所得产品的检测的实验:
| 推测 | 操作和现象 | 结论 |
| 杂质中的正盐成分可能有: Na2S Na2CO3 Na2SO3 Na2SO4 | ①取Wg产品配成稀溶液; ②向溶液中滴加过量BaCl2溶液,有白色沉淀生成,过滤,得沉淀和滤液; ③向沉淀中加入过量盐酸,沉淀完全溶解,并有刺激性气味的气体产生. | 产品杂质中: 一定含有Na2SO3, 可能含有Na2CO3 Na2S, 一定不含有Na2SO4. |
C6H8O6+I2═C6H6O6+2H++2I- 2S2O32-+I2═S4O62-+2I-
在一定体积的某维生素C溶液中加入a mol•L-1I2溶液V1mL,充分反应后,用Na2S2O3溶液滴定剩余的I2.上述滴定时,采用淀粉作指示剂,判断滴定终点的现象是滴加最后一滴Na2S2O3标准液时溶液由蓝色变为无色且半分钟内不变色.消耗b mol•L-1Na2S2O3溶液V2mL.该溶液中维生素C的物质的量是(aV1-$\frac{b{V}_{2}}{2}$)×10-3mol.
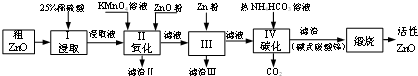
13.活性氧化锌是一种多功能的新型无机材料,某小组以粗氧化锌(含铁、铜的氧化物)为原料模拟工业生产活性氧化锌,步骤如图:
已知各相关氢氧化物沉淀pH范围如下表所示:
完成下列填空:
(1)步骤I中所需25%稀硫酸可用98%浓硫酸(密度为1.84g/mL)配制,所需的仪器除玻璃棒、烧杯、量筒外,还需要D(选填编号)
A.天平 B.滴定管 C.容量瓶 D.胶头滴管
(2)步骤Ⅱ中通过加入KMnO4的作用是MnO4-+5Fe2++8H+=5Fe3++Mn2++4H2O(用离子方程式表示);
(3)用ZnO调节pH,可以除去含铁杂质.检验Fe3+是否沉淀完全的实验操作是取少量溶液,滴加KSCN溶液,无颜色变化,说明沉淀完全,反应沉淀不完全,调节pH的适宜范围是4.1~4.7;
(4)步骤Ⅲ中加入Zn粉的作用是:①除去溶液中的Cu2+;②进一步调节溶液pH;
(5)步骤IV中使用热NH4HCO3溶液能促进Zn2+转化为沉淀,但温度不宜过高,其原因可能是NH4HCO3分解导致损失.
(6)用如下方法测定所得活性氧化锌的纯度:
①取1.000g活性氧化锌,用15.00mL 1.000mol/L硫酸溶液完全溶解,滴入几滴甲基橙,
②用浓度为0.500mol/L的标准氢氧化钠溶液滴定剩余硫酸,到达终点时消耗氢氧化钠溶液12.00mL.
判断滴定终点的方法是溶液颜色由红色变为黄色,且半分钟不变色,所得活性氧化锌的纯度为97.2%;
(7)已知常温下,CuS的溶度积常数Ksp=6.0×10-36,物质的量浓度为3.0×10-3mol•L-1Na2S溶液与等体积的CuSO4溶液中混合后立即产生沉淀,则CuSO4的浓度最小为4.0×10-33mol•L-1.

已知各相关氢氧化物沉淀pH范围如下表所示:
| Zn(OH)2 | Fe(OH)2 | Fe(OH)3 | Cu(OH)2 | |
| 开始沉淀pH | 5.4 | 7.0 | 2.3 | 4.7 |
| 完全沉淀pH | 8.0 | 9.0 | 4.1 | 6.7 |
(1)步骤I中所需25%稀硫酸可用98%浓硫酸(密度为1.84g/mL)配制,所需的仪器除玻璃棒、烧杯、量筒外,还需要D(选填编号)
A.天平 B.滴定管 C.容量瓶 D.胶头滴管
(2)步骤Ⅱ中通过加入KMnO4的作用是MnO4-+5Fe2++8H+=5Fe3++Mn2++4H2O(用离子方程式表示);
(3)用ZnO调节pH,可以除去含铁杂质.检验Fe3+是否沉淀完全的实验操作是取少量溶液,滴加KSCN溶液,无颜色变化,说明沉淀完全,反应沉淀不完全,调节pH的适宜范围是4.1~4.7;
(4)步骤Ⅲ中加入Zn粉的作用是:①除去溶液中的Cu2+;②进一步调节溶液pH;
(5)步骤IV中使用热NH4HCO3溶液能促进Zn2+转化为沉淀,但温度不宜过高,其原因可能是NH4HCO3分解导致损失.
(6)用如下方法测定所得活性氧化锌的纯度:
①取1.000g活性氧化锌,用15.00mL 1.000mol/L硫酸溶液完全溶解,滴入几滴甲基橙,
②用浓度为0.500mol/L的标准氢氧化钠溶液滴定剩余硫酸,到达终点时消耗氢氧化钠溶液12.00mL.
判断滴定终点的方法是溶液颜色由红色变为黄色,且半分钟不变色,所得活性氧化锌的纯度为97.2%;
(7)已知常温下,CuS的溶度积常数Ksp=6.0×10-36,物质的量浓度为3.0×10-3mol•L-1Na2S溶液与等体积的CuSO4溶液中混合后立即产生沉淀,则CuSO4的浓度最小为4.0×10-33mol•L-1.
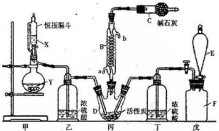
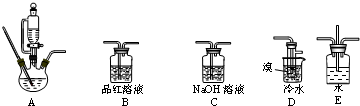
12.实验室利用下列仪器装置,由乙烯与溴的四氯化碳溶液反应制备1.2-二溴乙烷(加热及夹持设备已略).
有关数据列表如下:
请完成下列填空:
(1)实验装置的正确的连接顺序是(用仪器装置的字母填空,装置可重复选用)A→C→B→D→C;
(2)检查装置A气密性的方法是关闭恒压漏斗活塞,将导管浸入水中,对三颈烧瓶进行加热,导管口有气泡冒出,停止加热后导管内形成一段稳定的水柱,说明装置A气密性良好,反之气密性不好;
(3)A中药品为1:3的无水乙醇和浓硫酸混合液,写出制备乙烯的化学方程式:CH3CH2OH$→_{170℃}^{浓硫酸}$CH2═CH2↑+H2O;
(4)反应过程中应用冷水冷却装置D但又不能过度冷却,其原因是溴易挥发,冷却可以减少溴的挥发,而1,2-二溴乙烷的熔点为9℃,过度冷却可以使1,2-二溴乙烷凝结成固体,容易发生堵塞;
(5)学生发现反应结束时,无水乙醇消耗量大大超过理论值,其原因是乙醇易挥发、反应中存在副反应、反应剧烈导致乙烯与溴反应不完全等;
(6)老师建议,在A、B间加入装置E会更好,理由平衡装置内气体,防止倒吸.
0 170984 170992 170998 171002 171008 171010 171014 171020 171022 171028 171034 171038 171040 171044 171050 171052 171058 171062 171064 171068 171070 171074 171076 171078 171079 171080 171082 171083 171084 171086 171088 171092 171094 171098 171100 171104 171110 171112 171118 171122 171124 171128 171134 171140 171142 171148 171152 171154 171160 171164 171170 171178 203614
有关数据列表如下:
| 物质 状态 | 密度/g•cm3 | 沸点/℃熔点/℃ |
| 乙醇 无色液体 | 0.79 | 78.5/-130 |
| 1,2-二溴乙烷 无色液体 | 2.2 | 132/9 |
| 乙醚 无色液体 | 0.71 | 34.6/-116 |

请完成下列填空:
(1)实验装置的正确的连接顺序是(用仪器装置的字母填空,装置可重复选用)A→C→B→D→C;
(2)检查装置A气密性的方法是关闭恒压漏斗活塞,将导管浸入水中,对三颈烧瓶进行加热,导管口有气泡冒出,停止加热后导管内形成一段稳定的水柱,说明装置A气密性良好,反之气密性不好;
(3)A中药品为1:3的无水乙醇和浓硫酸混合液,写出制备乙烯的化学方程式:CH3CH2OH$→_{170℃}^{浓硫酸}$CH2═CH2↑+H2O;
(4)反应过程中应用冷水冷却装置D但又不能过度冷却,其原因是溴易挥发,冷却可以减少溴的挥发,而1,2-二溴乙烷的熔点为9℃,过度冷却可以使1,2-二溴乙烷凝结成固体,容易发生堵塞;
(5)学生发现反应结束时,无水乙醇消耗量大大超过理论值,其原因是乙醇易挥发、反应中存在副反应、反应剧烈导致乙烯与溴反应不完全等;
(6)老师建议,在A、B间加入装置E会更好,理由平衡装置内气体,防止倒吸.


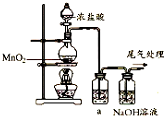 某兴趣小组的同学用如图装置制取漂白液(有效成分为NaClO),并研究其相关性质.
某兴趣小组的同学用如图装置制取漂白液(有效成分为NaClO),并研究其相关性质.