题目内容
15.资料显示:a.Na2S2O3、BaS2O3、BaS均易溶于水.b.SO2、Na2S、Na2CO3反应可生成Na2S2O3.
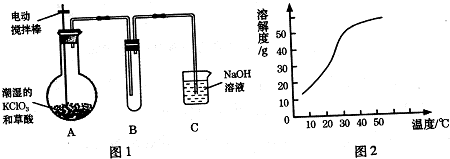
某化学小组据此进行了制备硫代硫酸钠晶体(Na2S2O3•5H2O)的探究.实验制备装置如图所示(省略夹持装置):

回答问题:
(1)仪器a的名称是分液漏斗.
(2)装置B的作用之一是观察SO2的生成速率.B中最好盛装的液体是c.
a.蒸馏水 b.饱和Na2SO3溶液 c.饱和NaHSO3溶液 d.饱和NaHCO3溶液
(3)在装置C中生成Na2S2O3.
①完成反应方程式:4SO2+2Na2S+1Na2CO3=3Na2S2O3+CO2
②反应开始先使A中发生反应一会儿,再使C中反应发生,其原因是排除装置内空气,防止发生氧化生成Na2SO4.
③结束反应后,取C中溶液,经蒸发浓缩、冷却结晶、过滤、洗涤、干燥、得到Na2S2O3•5H2O.
(4)完成对所得产品的检测的实验:
| 推测 | 操作和现象 | 结论 |
| 杂质中的正盐成分可能有: Na2S Na2CO3 Na2SO3 Na2SO4 | ①取Wg产品配成稀溶液; ②向溶液中滴加过量BaCl2溶液,有白色沉淀生成,过滤,得沉淀和滤液; ③向沉淀中加入过量盐酸,沉淀完全溶解,并有刺激性气味的气体产生. | 产品杂质中: 一定含有Na2SO3, 可能含有Na2CO3 Na2S, 一定不含有Na2SO4. |
C6H8O6+I2═C6H6O6+2H++2I- 2S2O32-+I2═S4O62-+2I-
在一定体积的某维生素C溶液中加入a mol•L-1I2溶液V1mL,充分反应后,用Na2S2O3溶液滴定剩余的I2.上述滴定时,采用淀粉作指示剂,判断滴定终点的现象是滴加最后一滴Na2S2O3标准液时溶液由蓝色变为无色且半分钟内不变色.消耗b mol•L-1Na2S2O3溶液V2mL.该溶液中维生素C的物质的量是(aV1-$\frac{b{V}_{2}}{2}$)×10-3mol.
分析 利用硫酸与亚硫酸钠反应制备二氧化硫,先排除装置中的空气,c中得到硫代硫酸钠,由题目信息可知,c中盛放Na2CO3和Na2S混合物,发生总反应为:Na2CO3+2Na2S+4SO2=3Na2S2O3+CO2,从C中溶液得到Na2S2O3•5H2O,需要经蒸发浓缩、冷却结晶、过滤洗涤、干燥,
(1)根据常见仪器的名称来解答;
(2)装置B中所盛放的液体应不能够与二氧化硫反应;
(3)①根据得失电子守恒和原子守恒配平化学方程式;
②空气中含有氧气,可以将产物氧化为Na2SO4,所以C中反应发生前,先要排除装置内空气,防止发生氧化生成Na2SO4;
③从溶液中制取晶体,一般采用蒸发结晶、过滤、洗涤、干燥的方法;
(4)①取Wg产品配成稀溶液;
②向溶液中滴加过量BaCl2溶液,有白色沉淀生成,说明杂质可能有:Na2CO3、Na2SO3、Na2SO4;
③向沉淀中加入过量盐酸,沉淀完全溶解,并有刺激性气味的气体产生,说明没有Na2SO4,一定有Na2SO3,可能有Na2CO3、结合题意,还可能有Na2S;
(5)碘单质被反应消耗后,溶液颜色从蓝色变化为无色,半分钟不变化说明达到终点;根据氧化还原反应中得失电子数相等进行计算;根据方程式计算维生素C的物质的量;
解答 解:(1)仪器a的名称是分液漏斗;
故答案为:分液漏斗;
(2)a.蒸馏水能与二氧化硫反应生成亚硫酸,故a错误,
b.饱和Na2SO3溶液与二氧化硫反应生成亚硫酸氢钠,故b错误;
c.饱和NaHSO3溶液与二氧化硫不反应,符合题意,故c正确;
d.饱和NaHCO3溶液能与二氧化硫反应生成亚硫酸钠和二氧化碳,故d错误;
故选:c;
(3)①S元素在二氧化硫中为+4价,在硫化钠中为-2价,反应后为+2价,所以二氧化硫和硫化钠物质的量之比为2:1,据原子守恒,二氧化硫钱的化学计量数为4,硫化钠的化学计量数为2,据原子守恒,还生成二氧化碳,化学方程式为:4SO2+2Na2S+Na2CO3=3Na2S2O3+CO2;
故答案为:4;2;1;3;CO2;
②空气中含有氧气,可以将产物氧化为Na2SO4,所以C中反应发生前,先要排除装置内空气,防止发生氧化生成Na2SO4;
故答案为:排除装置内空气,防止发生氧化生成Na2SO4;
③从C中溶液得到Na2S2O3•5H2O,需要经蒸发浓缩、冷却结晶、过滤洗涤、干燥,
故答案为:蒸发浓缩;冷却结晶;
(5)向溶液中滴加过量BaCl2溶液,有白色沉淀生成,说明杂质可能有:Na2CO3、Na2SO3、Na2SO4,向沉淀中加入过量盐酸,沉淀完全溶解,并有刺激性气味的气体产生,说明没有:Na2SO4,一定有Na2SO3,可能有Na2CO3,Na2S;
故答案为:
| 推测 | 操作和现象 | 结论 |
Na2SO3 | Na2SO3 Na2CO3 Na2S Na2SO4 |
故答案为:滴加最后一滴Na2S2O3标准液时溶液由蓝色变为无色且半分钟内不变色;(aV1-$\frac{b{V}_{2}}{2}$)×10-3;
点评 本题主要考查了无机物的制备、组成与含量测定,涉及知识点较多,培养了学生分析问题、解决问题,运用知识的能力,难度较大.

| A. | 原子半径:D>E>B>C>A | |
| B. | 热稳定性:EA4<A2C | |
| C. | B元素的最高价氧化物的水化物与D单质反应不能生成A2气体 | |
| D. | 化合物DC与化合物EC2中化学键类型相同 |
| A. | Na2CO3 | B. | Na2O | C. | CaO | D. | Al(OH)3 |
| A. | Al(OH)3 | B. | Al2O3 | C. | H2SiO3 | D. | MgCO3 |
| A. | CH4、C2H4 | B. | CH4、C2H5OH | C. | C2H6、C3H8 | D. | CH3CHO、C3H8 |
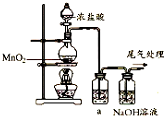 某兴趣小组的同学用如图装置制取漂白液(有效成分为NaClO),并研究其相关性质.
某兴趣小组的同学用如图装置制取漂白液(有效成分为NaClO),并研究其相关性质.
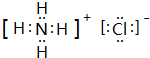 .
.