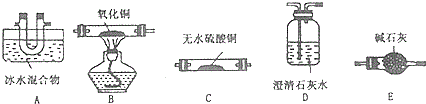
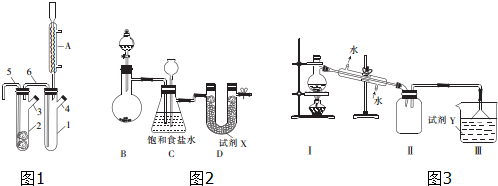
6.下列实验方法或操作能达到实验目的是( )
| A. |  除去甲烷中乙烯 | B. |  制备乙酸乙酯 | ||
| C. |  分离乙酸和水 | D. | 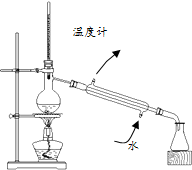 制备蒸馏水 |
2.硫酸亚锡(SnSO4)是一种重要的能溶于水的硫酸盐,广泛应用于镀锡工业.SnSO4的实验室制备设计路线如下:下列有关说法正确的是( )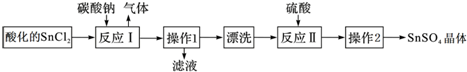

| A. | SnCl2酸化是为了防止溶解时发生水解 | |
| B. | 反应I中发生的离子反应为:CO32-+2H+=CO2↑+H2O | |
| C. | 漂洗时,将固体置于烧杯中,加蒸馏水洗涤过滤2~3次 | |
| D. | 操作1为过滤,操作2为结晶 |
1.利用含铜、铁的粗锌制备硫酸锌及相关物质.工艺流程图及有关数据如下:
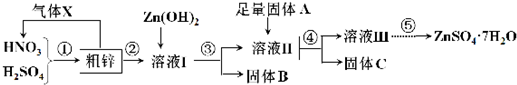
请回答下列问题:
(1)粗锌中的铜与混酸的稀溶液反应的化学方程式为3Cu+2HNO3(稀)+3H2SO4=3CuSO4+2NO↑+4H2O,图中处理气体X要能够体现绿色化学思想,还需补充气体O2(填化学式).
(2)若溶液I中c(Cu2+)为0.05mol•L-1,则溶液Ⅱ中c(Fe3+)>4.0×10-11mol•L-1.
(3)若固体A是Zn,取9.61g固体C溶解于足量的500mL2mol•L-1稀硝酸中,共收集到标准状况下2.24L的气体,向所得溶液中加入2mol•L-1NaOH溶液,则当生成沉淀最多时,沉淀的质量为14.71g;若固体A是另一种物质,取部分固体C于试管中,加入盐酸产生有臭鸡蛋味气体,则该反应的离子方程式为ZnS+2H+=H2S↑+Zn2+.
(4)溶液Ⅲ经过蒸发浓缩、冷却结晶、过滤、洗涤、干燥,即得到较纯净的硫酸锌晶体;溶液Ⅲ还可以制备ZnS,实际选择的是(NH4)2S溶液而不是Na2S溶液作为反应物,理由是后者制得的ZnS含有较多的杂质,则该杂质是Zn(OH)2(填化学式).
(5)金属锌常用作酸性干电池的负极,干电池不使用时,由于负极与电解质溶液接触而发生自放电反应:2NH${\;}_{4}^{+}$+Zn=2NH3+H2↑+Zn2+,造成电量自动减少.写出铅蓄电池不使用时,其正极上发生自放电的化学方程式.2PbO2+2H2SO4=2PbSO4+2H2O+O2↑.

| 物质 | Cu(OH)2 | Zn(OH)2 | Fe(OH)3 | ZnS | CuS |
| Ksp | 5.0×10-20 | 2.0×10-16 | 4.0×10-16 | 1.2×10-23 | 8.5×10-45 |
(1)粗锌中的铜与混酸的稀溶液反应的化学方程式为3Cu+2HNO3(稀)+3H2SO4=3CuSO4+2NO↑+4H2O,图中处理气体X要能够体现绿色化学思想,还需补充气体O2(填化学式).
(2)若溶液I中c(Cu2+)为0.05mol•L-1,则溶液Ⅱ中c(Fe3+)>4.0×10-11mol•L-1.
(3)若固体A是Zn,取9.61g固体C溶解于足量的500mL2mol•L-1稀硝酸中,共收集到标准状况下2.24L的气体,向所得溶液中加入2mol•L-1NaOH溶液,则当生成沉淀最多时,沉淀的质量为14.71g;若固体A是另一种物质,取部分固体C于试管中,加入盐酸产生有臭鸡蛋味气体,则该反应的离子方程式为ZnS+2H+=H2S↑+Zn2+.
(4)溶液Ⅲ经过蒸发浓缩、冷却结晶、过滤、洗涤、干燥,即得到较纯净的硫酸锌晶体;溶液Ⅲ还可以制备ZnS,实际选择的是(NH4)2S溶液而不是Na2S溶液作为反应物,理由是后者制得的ZnS含有较多的杂质,则该杂质是Zn(OH)2(填化学式).
(5)金属锌常用作酸性干电池的负极,干电池不使用时,由于负极与电解质溶液接触而发生自放电反应:2NH${\;}_{4}^{+}$+Zn=2NH3+H2↑+Zn2+,造成电量自动减少.写出铅蓄电池不使用时,其正极上发生自放电的化学方程式.2PbO2+2H2SO4=2PbSO4+2H2O+O2↑.
20.镍是有机合成的重要催化剂.某化工厂有含镍催化剂废品(主要成分是镍,杂质是铁、铝单质及其化合物,少量难溶性杂质).某学习小组设计如下流程利用含镍催化剂废品制备硫酸镍晶体:
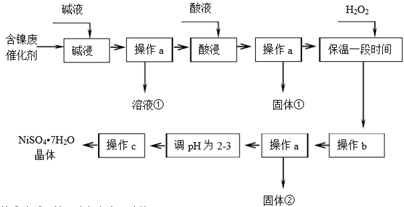
几种难溶碱开始沉淀和完全沉淀的pH:
回答下列问题:
(1)溶液①中含金属元素的离子是AlO2-.
(2)用离子方程式表示加入双氧水的目的2Fe2++H2O2+2H+=2Fe3++2H2O.
双氧水可以用下列物质替代的是A.
A.氧气 B.漂液 C.氯气 D.硝酸
(3)操作b调节溶液范围为3.2-7.1,其目的是除去Fe3+.固体②的化学式为Fe(OH)3.
(4)操作a和c需要共同的玻璃仪器是玻璃棒.上述流程中,防止浓缩结晶过程中Ni2+水解的措施是保持溶液呈酸性.
(5)如果加入双氧水量不足或“保温时间较短”,对实验结果的影响是产品中混有绿矾.
设计实验证明产品中是否含“杂质”:取少量样品溶于蒸馏水,滴加酸性高锰酸钾溶液,若溶液紫色褪去,则产品中含有Fe2+.(不考虑硫酸镍影响)
(6)取2.0000g硫酸镍晶体样品溶于蒸馏水,用0.2mol•L-1的EDTA(Na2H2Y)标准溶液滴定至终点,消耗EDTA标准溶液为34.50mL.滴定反应为Ni2++H2Y2-=NiY2-+2H+.计算样品纯度为97.0%.(已知,NiSO4•7H2O相对分子质量为281,不考虑杂质反应).

几种难溶碱开始沉淀和完全沉淀的pH:
| 沉淀物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Ni(OH)2 |
| 开始沉淀pH | 3.8 | 2.7 | 7.6 | 7.1 |
| 完全沉淀pH | 5.2 | 3.2 | 9.7 | 9.2 |
(1)溶液①中含金属元素的离子是AlO2-.
(2)用离子方程式表示加入双氧水的目的2Fe2++H2O2+2H+=2Fe3++2H2O.
双氧水可以用下列物质替代的是A.
A.氧气 B.漂液 C.氯气 D.硝酸
(3)操作b调节溶液范围为3.2-7.1,其目的是除去Fe3+.固体②的化学式为Fe(OH)3.
(4)操作a和c需要共同的玻璃仪器是玻璃棒.上述流程中,防止浓缩结晶过程中Ni2+水解的措施是保持溶液呈酸性.
(5)如果加入双氧水量不足或“保温时间较短”,对实验结果的影响是产品中混有绿矾.
设计实验证明产品中是否含“杂质”:取少量样品溶于蒸馏水,滴加酸性高锰酸钾溶液,若溶液紫色褪去,则产品中含有Fe2+.(不考虑硫酸镍影响)
(6)取2.0000g硫酸镍晶体样品溶于蒸馏水,用0.2mol•L-1的EDTA(Na2H2Y)标准溶液滴定至终点,消耗EDTA标准溶液为34.50mL.滴定反应为Ni2++H2Y2-=NiY2-+2H+.计算样品纯度为97.0%.(已知,NiSO4•7H2O相对分子质量为281,不考虑杂质反应).
18.铜和其化合物是中学化学的重要学习内容.
(1)自然界中各种原生铜的硫化物经氧化、淋滤作用后转化为硫酸铜溶液,并向溶部渗透,遇到深层的闪锌矿(ZnS)和方铅矿(PbS),慢慢地转变为铜蓝(CuS).
①硫化铜与氧气在淋滤作用下生成硫酸铜,该过程的化学方程式为CuS+2O2 $\frac{\underline{\;一定条件\;}}{\;}$CuSO4.
②渗透到地下深层的硫酸铜溶液遇到闪锌矿发生反应的离子方程式为Cu2+(aq)+ZnS(s)=CuS(s)+Zn2+(aq);请简要说明该反应能发生的原因:在一定条件下,溶解度小的矿物可以转化为溶解度更小的矿物.
(2)工业上利用辉铜矿(主要成分是Cu2S)冶炼铜,为了测定辉铜矿样品的纯度,可将样品与过量的酸性高锰酸钾溶液反应,该反应的离子方程式为Cu2S+2MnO4-+8H+=2Cu2++SO42-+2Mn2++4H2O.
(3)工业上可用多种方法制备硫酸晶体.如图是利用废铜屑(含杂质铁)制备胆矾(硫酸铜晶体)的流程图.
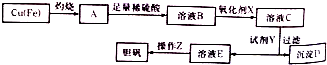
已知:
请回答:
①溶液B中含有的阳离子有Fe2+、Fe3+、H +、Cu2(填离子符号),氧化剂X宜选用的物质是H2O2(填化学式);
②加入试剂Y是为了调节pH,试剂Y可以选择的是CuO或CuCO3或Cu(OH)2;
③操作Z的步骤有蒸发浓缩、冷却结晶、过滤、洗涤、干燥等.
④将废铜屑投入到废酸(含硝酸、硫酸)中可以制备硫酸铜晶体,若某100mL废酸混合液中,c(HNO3)=2mol•L-1、c(H2SO4)=4mol•L-1(不含其他酸或氧化剂),则该废酸理论上最多能制备硫酸铜晶体(CuSO4•5H2O)的质量为75g.
⑤现有一块含有铜绿的铜片(假设不含其他杂质)在空气中灼烧可生成氧化铜等物质,经测定,反应前后固体的质量相同,则该铜片中铜的生锈率为34%[已知:金属生锈率=(已生锈的金属质量/金属的总质量)×100%].
0 170962 170970 170976 170980 170986 170988 170992 170998 171000 171006 171012 171016 171018 171022 171028 171030 171036 171040 171042 171046 171048 171052 171054 171056 171057 171058 171060 171061 171062 171064 171066 171070 171072 171076 171078 171082 171088 171090 171096 171100 171102 171106 171112 171118 171120 171126 171130 171132 171138 171142 171148 171156 203614
(1)自然界中各种原生铜的硫化物经氧化、淋滤作用后转化为硫酸铜溶液,并向溶部渗透,遇到深层的闪锌矿(ZnS)和方铅矿(PbS),慢慢地转变为铜蓝(CuS).
①硫化铜与氧气在淋滤作用下生成硫酸铜,该过程的化学方程式为CuS+2O2 $\frac{\underline{\;一定条件\;}}{\;}$CuSO4.
②渗透到地下深层的硫酸铜溶液遇到闪锌矿发生反应的离子方程式为Cu2+(aq)+ZnS(s)=CuS(s)+Zn2+(aq);请简要说明该反应能发生的原因:在一定条件下,溶解度小的矿物可以转化为溶解度更小的矿物.
(2)工业上利用辉铜矿(主要成分是Cu2S)冶炼铜,为了测定辉铜矿样品的纯度,可将样品与过量的酸性高锰酸钾溶液反应,该反应的离子方程式为Cu2S+2MnO4-+8H+=2Cu2++SO42-+2Mn2++4H2O.
(3)工业上可用多种方法制备硫酸晶体.如图是利用废铜屑(含杂质铁)制备胆矾(硫酸铜晶体)的流程图.

已知:
| 溶液中被沉淀离子 | Fe3+ | Fe2+ | Cu2+ |
| 完全生成氢氧化物沉淀时,溶液的pH | ≥3.7 | ≥6.4 | ≥4.4 |
①溶液B中含有的阳离子有Fe2+、Fe3+、H +、Cu2(填离子符号),氧化剂X宜选用的物质是H2O2(填化学式);
②加入试剂Y是为了调节pH,试剂Y可以选择的是CuO或CuCO3或Cu(OH)2;
③操作Z的步骤有蒸发浓缩、冷却结晶、过滤、洗涤、干燥等.
④将废铜屑投入到废酸(含硝酸、硫酸)中可以制备硫酸铜晶体,若某100mL废酸混合液中,c(HNO3)=2mol•L-1、c(H2SO4)=4mol•L-1(不含其他酸或氧化剂),则该废酸理论上最多能制备硫酸铜晶体(CuSO4•5H2O)的质量为75g.
⑤现有一块含有铜绿的铜片(假设不含其他杂质)在空气中灼烧可生成氧化铜等物质,经测定,反应前后固体的质量相同,则该铜片中铜的生锈率为34%[已知:金属生锈率=(已生锈的金属质量/金属的总质量)×100%].

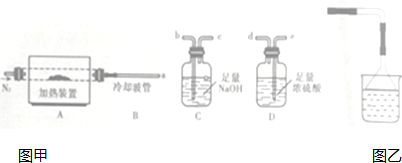
 某同学以甘蔗渣为原料用水解一氧化一水解循环进行制取草酸并探究测定草酸晶体(H2C2O4•xH2O)的某些性质.通过查阅资料可知:草酸易溶于水,是一种重要的化工原料,广泛用于药物生产、高分子合成等工业,草酸晶体受热到100℃时失去结晶水,成为无水草酸.157℃时大量升华,并开始分解;草酸蒸气在低温下可冷凝为固体;草酸钙不溶于水,草酸蒸气能使澄清石灰水变浑浊.
某同学以甘蔗渣为原料用水解一氧化一水解循环进行制取草酸并探究测定草酸晶体(H2C2O4•xH2O)的某些性质.通过查阅资料可知:草酸易溶于水,是一种重要的化工原料,广泛用于药物生产、高分子合成等工业,草酸晶体受热到100℃时失去结晶水,成为无水草酸.157℃时大量升华,并开始分解;草酸蒸气在低温下可冷凝为固体;草酸钙不溶于水,草酸蒸气能使澄清石灰水变浑浊.