题目内容
6.下列实验方法或操作能达到实验目的是( )| A. | 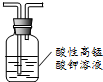 除去甲烷中乙烯 | B. |  制备乙酸乙酯 | ||
| C. |  分离乙酸和水 | D. | 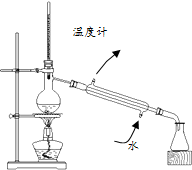 制备蒸馏水 |
分析 A.乙烯能被高锰酸钾氧化为二氧化碳;
B.乙酸乙酯能在NaOH溶液中水解;
C.乙酸和水互溶;
D.温度计应该放在蒸馏烧瓶的支管口处.
解答 解:A.乙烯能被高锰酸钾氧化为二氧化碳,引入新的杂质,故A错误;
B.NaOH溶液会使乙酸乙酯水解成乙酸和乙醇,故B错误;
C.乙酸和水互溶,不分层,故C错误;
D.蒸馏操作过程中,温度计应该放在蒸馏烧瓶的支管口处;冷凝管采用的是逆向通水法,这样使水能够与冷凝管中物质充分接触,冷凝效果好,故D正确.
故选D.
点评 本题考查化学实验方案的评价,为高频考点,涉及物质制备及分离与提纯等,侧重实验基本操作和实验原理的考查,注意装置的作用及实验的操作性、评价性分析,题目难度不大.

练习册系列答案
相关题目
4.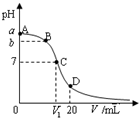 25℃,在20mL 0.1mol•L-1氨水溶液中逐滴加入0.1mol•L-1HCl溶液,其pH与所加盐酸溶液体积(V/mL)的关系如图所示,下列说法正确的是( )
25℃,在20mL 0.1mol•L-1氨水溶液中逐滴加入0.1mol•L-1HCl溶液,其pH与所加盐酸溶液体积(V/mL)的关系如图所示,下列说法正确的是( )
 25℃,在20mL 0.1mol•L-1氨水溶液中逐滴加入0.1mol•L-1HCl溶液,其pH与所加盐酸溶液体积(V/mL)的关系如图所示,下列说法正确的是( )
25℃,在20mL 0.1mol•L-1氨水溶液中逐滴加入0.1mol•L-1HCl溶液,其pH与所加盐酸溶液体积(V/mL)的关系如图所示,下列说法正确的是( )| A. | 已知25℃时 0.1 mol•L-1氨水电离度为1.33%,则b<a<1 | |
| B. | 在C点,V1<10,且有c(NH4+)=c(Cl-)=c(OH-)=c(H+) | |
| C. | 在A、C间任一点,溶液中一定都有:c(NH4+)>c(Cl-)>c(OH-)>c(H+) | |
| D. | 在D点:c(NH4+)+c(NH3•H2O)=c(Cl-) |
1.利用含铜、铁的粗锌制备硫酸锌及相关物质.工艺流程图及有关数据如下:
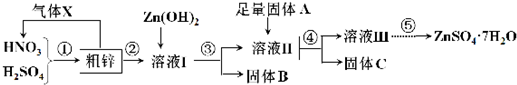
请回答下列问题:
(1)粗锌中的铜与混酸的稀溶液反应的化学方程式为3Cu+2HNO3(稀)+3H2SO4=3CuSO4+2NO↑+4H2O,图中处理气体X要能够体现绿色化学思想,还需补充气体O2(填化学式).
(2)若溶液I中c(Cu2+)为0.05mol•L-1,则溶液Ⅱ中c(Fe3+)>4.0×10-11mol•L-1.
(3)若固体A是Zn,取9.61g固体C溶解于足量的500mL2mol•L-1稀硝酸中,共收集到标准状况下2.24L的气体,向所得溶液中加入2mol•L-1NaOH溶液,则当生成沉淀最多时,沉淀的质量为14.71g;若固体A是另一种物质,取部分固体C于试管中,加入盐酸产生有臭鸡蛋味气体,则该反应的离子方程式为ZnS+2H+=H2S↑+Zn2+.
(4)溶液Ⅲ经过蒸发浓缩、冷却结晶、过滤、洗涤、干燥,即得到较纯净的硫酸锌晶体;溶液Ⅲ还可以制备ZnS,实际选择的是(NH4)2S溶液而不是Na2S溶液作为反应物,理由是后者制得的ZnS含有较多的杂质,则该杂质是Zn(OH)2(填化学式).
(5)金属锌常用作酸性干电池的负极,干电池不使用时,由于负极与电解质溶液接触而发生自放电反应:2NH${\;}_{4}^{+}$+Zn=2NH3+H2↑+Zn2+,造成电量自动减少.写出铅蓄电池不使用时,其正极上发生自放电的化学方程式.2PbO2+2H2SO4=2PbSO4+2H2O+O2↑.

| 物质 | Cu(OH)2 | Zn(OH)2 | Fe(OH)3 | ZnS | CuS |
| Ksp | 5.0×10-20 | 2.0×10-16 | 4.0×10-16 | 1.2×10-23 | 8.5×10-45 |
(1)粗锌中的铜与混酸的稀溶液反应的化学方程式为3Cu+2HNO3(稀)+3H2SO4=3CuSO4+2NO↑+4H2O,图中处理气体X要能够体现绿色化学思想,还需补充气体O2(填化学式).
(2)若溶液I中c(Cu2+)为0.05mol•L-1,则溶液Ⅱ中c(Fe3+)>4.0×10-11mol•L-1.
(3)若固体A是Zn,取9.61g固体C溶解于足量的500mL2mol•L-1稀硝酸中,共收集到标准状况下2.24L的气体,向所得溶液中加入2mol•L-1NaOH溶液,则当生成沉淀最多时,沉淀的质量为14.71g;若固体A是另一种物质,取部分固体C于试管中,加入盐酸产生有臭鸡蛋味气体,则该反应的离子方程式为ZnS+2H+=H2S↑+Zn2+.
(4)溶液Ⅲ经过蒸发浓缩、冷却结晶、过滤、洗涤、干燥,即得到较纯净的硫酸锌晶体;溶液Ⅲ还可以制备ZnS,实际选择的是(NH4)2S溶液而不是Na2S溶液作为反应物,理由是后者制得的ZnS含有较多的杂质,则该杂质是Zn(OH)2(填化学式).
(5)金属锌常用作酸性干电池的负极,干电池不使用时,由于负极与电解质溶液接触而发生自放电反应:2NH${\;}_{4}^{+}$+Zn=2NH3+H2↑+Zn2+,造成电量自动减少.写出铅蓄电池不使用时,其正极上发生自放电的化学方程式.2PbO2+2H2SO4=2PbSO4+2H2O+O2↑.
15.下列离子方程式书写正确的是( )
| A. | 铝与氢氧化钠溶液反应:Al+2OH-═AlO2-+H2↑ | |
| B. | 向硫酸铝中加入过量氨水:Al3++4NH3•H2O═AlO2-+2H2O+4NH4+ | |
| C. | NH4HCO3溶液与足量NaOH溶液共热:NH4++HCO3-+2OH-$\frac{\underline{\;\;△\;\;}}{\;}$ NH3↑+2H2O+CO32- | |
| D. | 浓硝酸中加入过量铁粉并加热:Fe+3NO3-+6H+ $\frac{\underline{\;\;△\;\;}}{\;}$ Fe3++3NO2↑+3H2O |
16.下列有关说法中,正确的是( )
| A. | 盐酸、漂白粉都是混合物 | B. | 127I和131I互为同素异形体 | ||
| C. | 硫酸铜、二氧化硫都是电解质 | D. | 分馏、干馏都是物理变化 |

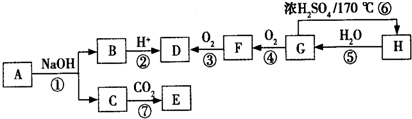
 .
.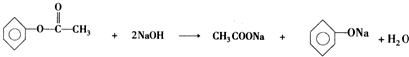 ;
;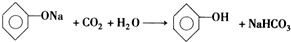 .
.