题目内容
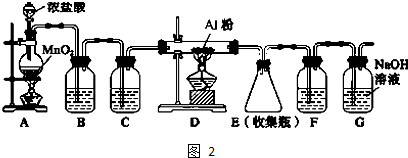
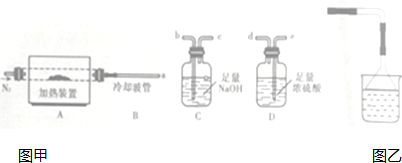
19.颗粒大小达到纳米级的单质铁俗称“纳米铁”,可用作手机辐射屏蔽材料.实验室的制备方法是:以高纯氮气作保护气,在高温条件下用H2和FeCl2反应生成“纳米铁”,实验装置如下图.请回答: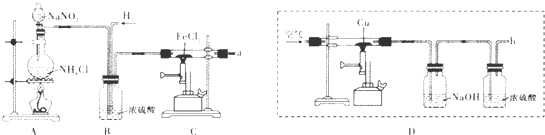
(1)A装置用于制取,反应的化学方程式为NaNO2+NH4Cl$\frac{\underline{\;加热\;}}{\;}$NaCl+N2+2H2O.
(2)实验时,应先将N2(填“N2”或“H2”)通入C装置,反应生成“纳米铁”的化学方程式为;实验中需要保护气的原因是排尽空气,防止生成的铁能与空气中的氧气反应.
(3)a导管口的气态产物除HC1外还可能有NH3(填化学式).
(4)利用D装置也可以得到较纯净的氮气.但科学家发现,采用此方法在b导管口得到的氮 气在相同条件下比原方法得到的氮气密度略大,原因是制得的氮气中会含有密度比空气大的气体(假设上述实验设计与操作均无错误,且氮气已完全干燥);若开始加入的铜粉质量为3.84g,持续通人空气至铜粉全部反应,冷却后固体质量为4.48g,则固体的成分为CuO和Cu2O,反应的化学方程式为3Cu+O2$\frac{\underline{\;高温\;}}{\;}$CuO+Cu2O.
分析 (1)根据题目信息结合质量守恒可知亚硝酸钠与氯化氨反应生成氮气、氯化钠和水,据此写出方程式;
(2)根据题目信息可知,要通过氮气排出装置中的空气;在高温条件下用H2和FeCl2反应生成“纳米铁”和氯化氢,据此书写方程式;生成的铁能与空气中的氧气反应;
(3)氮气和氢气在高温条件下能反应生成氨气;
(4)利用D装置收集氮气不纯;根据极限法计算确定固体的成分,然后书写方程式.
解答 解:(1)亚硝酸钠与氯化氨反应生成氮气、氯化钠和水,方程式为:NaNO2+NH4Cl$\frac{\underline{\;加热\;}}{\;}$NaCl+N2+2H2O;
故答案为:NaNO2+NH4Cl$\frac{\underline{\;加热\;}}{\;}$NaCl+N2+2H2O;
(2)实验时,应先将N2通入C装置,排出装置中的空气,在高温条件下用H2和FeCl2反应生成“纳米铁”和氯化氢,方程式为:H2+FeCl2$\frac{\underline{\;高温\;}}{\;}$Fe+2HCl,实验中需要保护气的原因是排尽空气,防止生成的铁能与空气中的氧气反应;
故答案为:N2;H2+FeCl2$\frac{\underline{\;高温\;}}{\;}$Fe+2HCl;排尽空气,防止生成的铁能与空气中的氧气反应;
(3)氮气和氢气在高温条件下能反应生成氨气,所以a导管口的气态产物除HC1外还可能有NH3;
故答案为:NH3;
(4)利用D装置收集氮气中会含有密度比空气大的气体;铜粉质量为3.84g,其物质的量为$\frac{3.84g}{64g/mol}$=0.06mol,冷却后固体质量为4.48g,其中含有氧原子的质量为4.48g-3.84g=0.64g,其物质的量为$\frac{0.64g}{16/molg}$=0.4mol,由此可知铜原子的个数与氧原子的个数之比3:2,所以固体的成分为CuO和Cu2O,其方程式为:
3Cu+O2$\frac{\underline{\;高温\;}}{\;}$CuO+Cu2O;
故答案为:制得的氮气中会含有密度比空气大的气体;CuO和Cu2O;3Cu+O2$\frac{\underline{\;高温\;}}{\;}$CuO+Cu2O.
点评 本题是一道信息题,主要考查了物质的性质与方程式的书写,难度不大,培养了学生运用信息的能力.

 阅读快车系列答案
阅读快车系列答案
| A. | 香兰素的化学式为C8H8O3 | |
| B. | 能与Na2CO3和NaOH溶液反应 | |
| C. | 1 mol香兰素只能与含1 mol Br2的溴水反应 | |
| D. | 能使酸性高锰酸钾溶液褪色的官能团有羟基和醛基 |
| A. | 非金属单质燃烧时火焰均为无色 | |
| B. | NaCl与Na2CO3灼烧时火焰颜色相同 | |
| C. | 焰色反应均应透过蓝色钴玻璃观察 | |
| D. | 所有金属及其化合物灼烧时火焰均有颜色 |
| A. | 沉淀转化反应2AgCl(s)+CO32-(aq)?Ag2CO3(s)+2Cl-(aq)的平衡常数为20mol•L-1 | |
| B. | 反应后溶液中的:c(Na+)>c(Cl-)=c(Ag+)>c(CO32-)>c(OH-)>c(H+ ) | |
| C. | 反应后溶液中的:c(Na+)+c(H+)+c( Ag+)=2c(CO32-)+c(Cl-)+c(OH-)+c(HCO3-) | |
| D. | 约有4×10-5molAgCl溶解 |