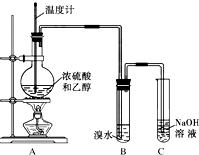
16.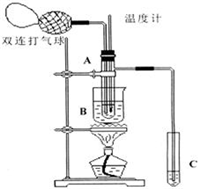 乙醛在氧化铜催化剂存在的条件下,可以被空气氧化成乙酸.依据此原理设计实验制得并在试管C中收集到少量乙酸溶液(如图所示:试管A中装有40%的乙醛水溶液、氧化铜粉末;试管C中装有适量蒸馏水;烧杯B中装有某液体).已知在60℃~80℃时用双连打气球鼓入空气即可发生乙醛的氧化反应,连续鼓入十几次反应基本完全.有关物质的沸点见下表:
乙醛在氧化铜催化剂存在的条件下,可以被空气氧化成乙酸.依据此原理设计实验制得并在试管C中收集到少量乙酸溶液(如图所示:试管A中装有40%的乙醛水溶液、氧化铜粉末;试管C中装有适量蒸馏水;烧杯B中装有某液体).已知在60℃~80℃时用双连打气球鼓入空气即可发生乙醛的氧化反应,连续鼓入十几次反应基本完全.有关物质的沸点见下表:
请回答下列问题:
(1)试管A内在60~80℃时发生的主要反应的化学方程式为(注明反应条件)2CH3CHO+O2$→_{CuO}^{60℃-80℃}$2CH3COOH;
(2)如图所示在实验的不同阶段,需要调整温度计在试管A内的位置,在实验开始时温度计水银球的位置应在试管A的反应液中;目的是测量反应溶液的温度;当试管A内的主要反应完成后温度计水银球的位置应在试管A的支管口处,目的是收集含乙酸的馏分;
(3)烧杯B的作用是使试管A内的反应液均匀受热发生反应,使生成的乙酸变成蒸气进入试管C;烧杯B内盛装的液体可以是乙二醇(甘油)(写出一种即可,在题给物质中找);
(4)若想检验试管C中是否含有产物乙酸,请你在所提供的药品中进行选择,设计一个简便的实验方案.所提供的药品有:pH试纸、红色的石蕊试纸、白色的醋酸铅试纸、碳酸氢钠粉末.实验仪器任选.该方案为:
将少量碳酸氢钠粉未,放入一个洁净的试管中,加入少量试管C中的液体,若有气体产生,则说明试管C中含有产物乙酸(或把一块pH试纸放在表面皿(或玻璃片)上,用洁净、干燥的玻璃棒蘸取试管C内的液体,点在pH试纸中部,试纸变色后,用标准比色卡比较来确定溶液的pH,进而说明是否有乙酸生成).
 乙醛在氧化铜催化剂存在的条件下,可以被空气氧化成乙酸.依据此原理设计实验制得并在试管C中收集到少量乙酸溶液(如图所示:试管A中装有40%的乙醛水溶液、氧化铜粉末;试管C中装有适量蒸馏水;烧杯B中装有某液体).已知在60℃~80℃时用双连打气球鼓入空气即可发生乙醛的氧化反应,连续鼓入十几次反应基本完全.有关物质的沸点见下表:
乙醛在氧化铜催化剂存在的条件下,可以被空气氧化成乙酸.依据此原理设计实验制得并在试管C中收集到少量乙酸溶液(如图所示:试管A中装有40%的乙醛水溶液、氧化铜粉末;试管C中装有适量蒸馏水;烧杯B中装有某液体).已知在60℃~80℃时用双连打气球鼓入空气即可发生乙醛的氧化反应,连续鼓入十几次反应基本完全.有关物质的沸点见下表:| 物质 | 乙醛 | 乙酸 | 甘油 | 乙二醇 | 水 |
| 沸点 | 20.8℃ | 117.9℃ | 290℃ | 197.2℃ | 100℃ |
(1)试管A内在60~80℃时发生的主要反应的化学方程式为(注明反应条件)2CH3CHO+O2$→_{CuO}^{60℃-80℃}$2CH3COOH;
(2)如图所示在实验的不同阶段,需要调整温度计在试管A内的位置,在实验开始时温度计水银球的位置应在试管A的反应液中;目的是测量反应溶液的温度;当试管A内的主要反应完成后温度计水银球的位置应在试管A的支管口处,目的是收集含乙酸的馏分;
(3)烧杯B的作用是使试管A内的反应液均匀受热发生反应,使生成的乙酸变成蒸气进入试管C;烧杯B内盛装的液体可以是乙二醇(甘油)(写出一种即可,在题给物质中找);
(4)若想检验试管C中是否含有产物乙酸,请你在所提供的药品中进行选择,设计一个简便的实验方案.所提供的药品有:pH试纸、红色的石蕊试纸、白色的醋酸铅试纸、碳酸氢钠粉末.实验仪器任选.该方案为:
将少量碳酸氢钠粉未,放入一个洁净的试管中,加入少量试管C中的液体,若有气体产生,则说明试管C中含有产物乙酸(或把一块pH试纸放在表面皿(或玻璃片)上,用洁净、干燥的玻璃棒蘸取试管C内的液体,点在pH试纸中部,试纸变色后,用标准比色卡比较来确定溶液的pH,进而说明是否有乙酸生成).
15.加强空气质量检测,客观分析空气中污染物的来源及性质,将有助于制定有针对性的治理措施.下表是某城市某日的空气质量报告:
该市某校研究性学习小组对表中首要污染物SO2导致酸雨的成因进行了如下探究:
(1)用下图所示装置进行实验.
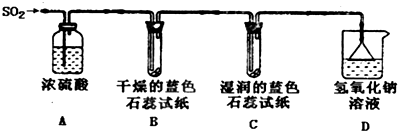
①A装置的作用是干燥.
②实验过程中,B装置内石蕊试纸的颜色没有发生变化,C装置内湿润的蓝色石蕊试纸变成红色,说明SO2与水反应生成一种酸,其化学反应方程式是S02+H20?H2S03.
③D装置的作用是吸收多余SO2气体,避免污染空气,
D中发生反应的化学方程式是S02+2NaOH=Na2S03+H20.
(2)往盛有水的烧杯中通入SO2气体,测得所得溶液的pH<7(填“>”“=”或“<”),然后每隔1h测定其pH,发现pH逐渐变小(填“变大”或“变小”),直至恒定,原因是2H2SO3+O2=4H++2SO42-(写出反应的离子方程式).
(3)SO2形成酸雨的另一途径为:SO2与空气中的O2在飘尘的作用下反应生成SO3,SO3溶于降水生成H2SO4,则在此过程中的飘尘是作为催化剂(填“催化剂”或“氧化剂”).
(4)SO2与空气中的氧气、水反应生成硫酸而形成酸雨.该市可能易出现酸雨.汽车排放的尾气,硝酸、化肥等工业生产排出的废气中都含有氮的氧化物,氮的氧化物溶于水最终转化为HNO3,是造成酸雨的另一主要原因.
| 污染指数 | 首要污染物 | 空气质量级别 | 空气质量状况 |
| 55 | SO2 | II | 良 |
(1)用下图所示装置进行实验.

①A装置的作用是干燥.
②实验过程中,B装置内石蕊试纸的颜色没有发生变化,C装置内湿润的蓝色石蕊试纸变成红色,说明SO2与水反应生成一种酸,其化学反应方程式是S02+H20?H2S03.
③D装置的作用是吸收多余SO2气体,避免污染空气,
D中发生反应的化学方程式是S02+2NaOH=Na2S03+H20.
(2)往盛有水的烧杯中通入SO2气体,测得所得溶液的pH<7(填“>”“=”或“<”),然后每隔1h测定其pH,发现pH逐渐变小(填“变大”或“变小”),直至恒定,原因是2H2SO3+O2=4H++2SO42-(写出反应的离子方程式).
(3)SO2形成酸雨的另一途径为:SO2与空气中的O2在飘尘的作用下反应生成SO3,SO3溶于降水生成H2SO4,则在此过程中的飘尘是作为催化剂(填“催化剂”或“氧化剂”).
(4)SO2与空气中的氧气、水反应生成硫酸而形成酸雨.该市可能易出现酸雨.汽车排放的尾气,硝酸、化肥等工业生产排出的废气中都含有氮的氧化物,氮的氧化物溶于水最终转化为HNO3,是造成酸雨的另一主要原因.
11.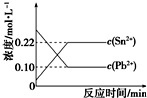 25℃时,在含有Pb2+、Sn2+的某溶液中,加入过量金属锡(Sn),发生反应:Sn(s)+Pb2+(aq)?Sn2+(aq)+Pb(s),体系中c(Pb2+)和c(Sn2+)变化关系如图所示.下列判断正确的是( )
25℃时,在含有Pb2+、Sn2+的某溶液中,加入过量金属锡(Sn),发生反应:Sn(s)+Pb2+(aq)?Sn2+(aq)+Pb(s),体系中c(Pb2+)和c(Sn2+)变化关系如图所示.下列判断正确的是( )
 25℃时,在含有Pb2+、Sn2+的某溶液中,加入过量金属锡(Sn),发生反应:Sn(s)+Pb2+(aq)?Sn2+(aq)+Pb(s),体系中c(Pb2+)和c(Sn2+)变化关系如图所示.下列判断正确的是( )
25℃时,在含有Pb2+、Sn2+的某溶液中,加入过量金属锡(Sn),发生反应:Sn(s)+Pb2+(aq)?Sn2+(aq)+Pb(s),体系中c(Pb2+)和c(Sn2+)变化关系如图所示.下列判断正确的是( )| A. | 25℃时,该反应的平衡常数K=2.2 | |
| B. | 往平衡体系中加入金属铅后,c(Pb2+)增大 | |
| C. | 往平衡体系中加入少量Sn(NO3)2固体后,c(Pb2+)变小 | |
| D. | 升高温度,平衡体系中c(Pb2+)增大,说明该反应△H>0 |
8.某化学实验小组的同学用下列仪器组装两套完全相同的如图1装置定量探究浓度对反应速率的影响.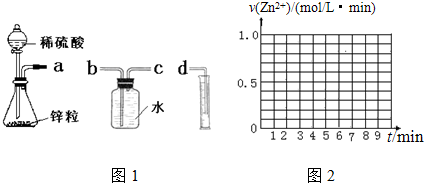
(1)为达到本实验目的其装置连接顺序为:a连c,b连d.
(2)实验开始后,锥形瓶中发生反应的离子方程式为Zn+2H+═Zn2++H2↑.
(3)两套装置的分液漏斗所装的试剂分别为1mol/L硫酸溶液和4mol/L硫酸溶液,该小组同学要测定并记录的数据如下表:
该小组同学通过实验得到的结果是:v1小于v2,其定量依据是t1>t2.
(4)另有一组同学测定了每隔一分钟,锥形瓶中硫酸的浓度,记录结果如下:
请在下面给定的坐标图2中作出v(Zn2+)-t的图象.
请解释0到4mim时该化学反应速率随时间变化的原因:该反应为放热反应,随反应的进行,温度不断升高,所以反应速率不断加快.
(5)除上述实验方案可定量测定该反应的化学反应速率外,还可能有的实验测定方案有:相同时间内测定生成H2的体积;相同时间内测定Zn的质量(任写一种).
0 170882 170890 170896 170900 170906 170908 170912 170918 170920 170926 170932 170936 170938 170942 170948 170950 170956 170960 170962 170966 170968 170972 170974 170976 170977 170978 170980 170981 170982 170984 170986 170990 170992 170996 170998 171002 171008 171010 171016 171020 171022 171026 171032 171038 171040 171046 171050 171052 171058 171062 171068 171076 203614
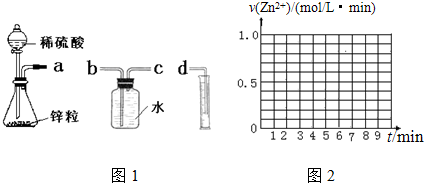
(1)为达到本实验目的其装置连接顺序为:a连c,b连d.
(2)实验开始后,锥形瓶中发生反应的离子方程式为Zn+2H+═Zn2++H2↑.
(3)两套装置的分液漏斗所装的试剂分别为1mol/L硫酸溶液和4mol/L硫酸溶液,该小组同学要测定并记录的数据如下表:
| 加入的试剂 | H2的体积(相同条件下) | 反应时间 | 反应速率 |
| 1mol/L硫酸溶液 | 10mL | t1 | v1 |
| 4mol/L硫酸溶液 | 10mL | t2 | v2 |
(4)另有一组同学测定了每隔一分钟,锥形瓶中硫酸的浓度,记录结果如下:
| 时间(min) | 0 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| 硫酸浓度(mol/L) | 4.0 | 3.8 | 3.5 | 3.1 | 2.6 | 2.2 | 1.9 | 1.8 | … |
请解释0到4mim时该化学反应速率随时间变化的原因:该反应为放热反应,随反应的进行,温度不断升高,所以反应速率不断加快.
(5)除上述实验方案可定量测定该反应的化学反应速率外,还可能有的实验测定方案有:相同时间内测定生成H2的体积;相同时间内测定Zn的质量(任写一种).
 (1)某催化剂可将汽车尾气中的CO、NO转化为无毒气体.已知:
(1)某催化剂可将汽车尾气中的CO、NO转化为无毒气体.已知:
 为探究乙烯的制取及乙烯和溴水反应的有关问题,甲、乙、丙三同学进行了如下实验活动,请你参与他们的活动并回答相关问题.
为探究乙烯的制取及乙烯和溴水反应的有关问题,甲、乙、丙三同学进行了如下实验活动,请你参与他们的活动并回答相关问题. 目前广泛使用的工业合成氨方法是用氮气和氢气在一定条件下化合.
目前广泛使用的工业合成氨方法是用氮气和氢气在一定条件下化合.