题目内容
8.某化学实验小组的同学用下列仪器组装两套完全相同的如图1装置定量探究浓度对反应速率的影响.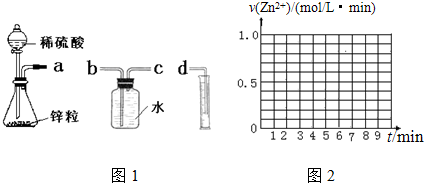
(1)为达到本实验目的其装置连接顺序为:a连c,b连d.
(2)实验开始后,锥形瓶中发生反应的离子方程式为Zn+2H+═Zn2++H2↑.
(3)两套装置的分液漏斗所装的试剂分别为1mol/L硫酸溶液和4mol/L硫酸溶液,该小组同学要测定并记录的数据如下表:
| 加入的试剂 | H2的体积(相同条件下) | 反应时间 | 反应速率 |
| 1mol/L硫酸溶液 | 10mL | t1 | v1 |
| 4mol/L硫酸溶液 | 10mL | t2 | v2 |
(4)另有一组同学测定了每隔一分钟,锥形瓶中硫酸的浓度,记录结果如下:
| 时间(min) | 0 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| 硫酸浓度(mol/L) | 4.0 | 3.8 | 3.5 | 3.1 | 2.6 | 2.2 | 1.9 | 1.8 | … |
请解释0到4mim时该化学反应速率随时间变化的原因:该反应为放热反应,随反应的进行,温度不断升高,所以反应速率不断加快.
(5)除上述实验方案可定量测定该反应的化学反应速率外,还可能有的实验测定方案有:相同时间内测定生成H2的体积;相同时间内测定Zn的质量(任写一种).
分析 (1)图示装置按照发生装置、排水法测量气体体积的顺序进行连接;
(2)锥形瓶中锌与稀硫酸反应生成硫酸锌和氢气,据此写出反应的离子方程式;
(3)根据浓度对反应速率的影响进行判断t1、t2的大小关系;
(4)根据表中不同时间段稀硫酸的浓度可以画出v(H2)-t的图象;根据该反应为放热反应及温度对反应速率的影响进行判断;
(5)还可以通过测定相同时间内生成氢气的体积来判断浓度对反应速率的影响.
解答 解:(1)根据图示装置可知,实验目的是通过排水法测定生成氢气体积,其中集气瓶中的导管应该为短进长出法,所以导管连接顺序为:a→c→b→d,
故答案为:c;b;d;
(2)锥形瓶中稀硫酸与金属锌发生反应生成氢气,反应的离子方程式为:Zn+2H+=Zn2++H2↑,故答案为:Zn+2H+=Zn2++H2↑;
(3)其它条件相同时,稀硫酸的浓度越大,反应速率越快,收集相同体积的氢气需要的时间越短,所以t1>t2,故答案为:t1>t2;
(4)由表中时间与稀硫酸的浓度关系可以画出v(H2)-t的图象为: ;由于该反应为放热反应,随反应的进行,温度不断升高,所以反应速率不断加快,
;由于该反应为放热反应,随反应的进行,温度不断升高,所以反应速率不断加快,
故答案为: ;该反应为放热反应,随反应的进行,温度不断升高,所以反应速率不断加快;
;该反应为放热反应,随反应的进行,温度不断升高,所以反应速率不断加快;
(5)除上述实验方案可定量测定该反应的化学反应速率外,还可以通过测定相同时间内测定生成H2的体积进行判断浓度对反应速率的影响,
故答案为:相同时间内测定生成H2的体积(或相同时间内测定Zn的质量)(其他合理答案均可).
点评 本题考查了探究浓度对反应速率的影响的方法,题目难度中等,注意明确难度对化学反应速率的影响,要求学生能够合理设计出探究浓度对反应速率影响的实验方案,并能够对实验方案的合理性进行正确评价.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
19.下列叙述正确的是( )
| A. | Na2CO3溶液加水稀释后,恢复至原温度,所有离子浓度均减小 | |
| B. | pH=5的CH3COOH溶液和pH=5的NH4Cl溶液中,c(H+)相等 | |
| C. | pH=12的Ba(OH)2溶液和pH=12的Na2CO3溶液中,水电离的c(H+)前者大 | |
| D. | 0.1mol•L-1CH3COONa溶液中:c(Na+)>c(CH3COO-)>c(H+)>c(OH-) |
19.下列说法正确的是( )
| A. | 乙烯和苯都可以使溴水反应褪色 | |
| B. | 甲烷和乙烯都可以与氯气反应 | |
| C. | 乙烯可以与氢气发生加成反应,苯不能与氢气加成 | |
| D. | 液化石油气和天然气的主要成分都是甲烷 |
20.在水溶液中能大量共存,加入过量的稀H2SO4后有沉淀和气体产生的离子组是( )
| A. | HCO3-,Cl-,Na+,Ba2+ | B. | AlO2-,S2-,Na+,K+ | ||
| C. | SiO32-,Cl-,K+,Na+ | D. | Ba2+,Al3+,NO3-,Cl- |
18.有文献记载:在强碱条件下,加热银氨溶液可能析出银镜.某同学进行如表验证和对比实验.
该同学欲分析实验Ⅰ和实验Ⅱ的差异,查阅资料:
a.Ag(NH3)2++2H2O?Ag++2NH3H2O
b.AgOH不稳定,极易分解为黑色Ag2O
(1)配制银氨溶液所需的药品是2%硝酸银,2%稀氨水.
(2)经检验,实验Ⅰ的气体中有NH3,黑色物质中有Ag2O.
①用湿润的红色石蕊试纸检验NH3产生的现象是红色石蕊试纸变蓝.
②产生Ag2O的原因是水浴加热,促使NH3•H2O分解成氨气逸出,使得可逆反应平衡右移,促进了银氨络离子向银离子的转化,银离子和氢氧根离子反应生成氢氧化银,AgOH不稳定,水浴加热分解为黑色Ag2O.
(3)该同学对产生银镜的原因提出假设:可能是NaOH还原Ag2O.实验及现象:向AgNO3溶液中加入过量NaOH溶液,出现黑色沉淀,水浴加热,未出现银镜.
(4)重新假设:在NaOH存在下可能是NH3还原Ag2O.用如图1所示装置进行实验,现象:出现银镜.在虚线框内画出用生石灰和浓氨水制取NH3的装置简图(夹持仪器略).
(5)该同学认为在(4)的实验中会有Ag(NH3)2OH生成,由此又提出假设:在NaOH存在下,可能是Ag(NH3)2OH也参与了NH3还原Ag2O的反应.进行如图2实验:
①有部分Ag2O溶解在氨水中,该反应的化学方程式是Ag2O+4NH3•H2O=2Ag(NH3)2OH+3H2O.
②实验结果证实假设成立,依据的现象是与溶液接触的试管壁上析出银镜.
③用HNO3清洗试管壁上的Ag,该反应的化学方程式是2HNO3(浓)+Ag═AgNO3+2NO2↑+H2O.
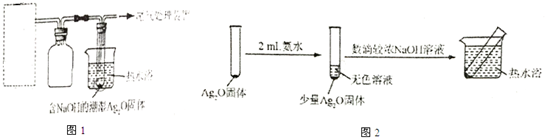
| 装置 | 实验序号 | 试管中的药品 | 现象 |
 | 实验Ⅰ | 2mL银氨溶液和数滴较浓NaOH溶液 | 有气泡产生,一段时间后,溶液逐渐变黑,试管壁附着银镜 |
| 实验Ⅱ | 2mL银氨溶液和数滴较浓氨水 | 有气泡产生,一段时间后,溶液无明显变化 |
a.Ag(NH3)2++2H2O?Ag++2NH3H2O
b.AgOH不稳定,极易分解为黑色Ag2O
(1)配制银氨溶液所需的药品是2%硝酸银,2%稀氨水.
(2)经检验,实验Ⅰ的气体中有NH3,黑色物质中有Ag2O.
①用湿润的红色石蕊试纸检验NH3产生的现象是红色石蕊试纸变蓝.
②产生Ag2O的原因是水浴加热,促使NH3•H2O分解成氨气逸出,使得可逆反应平衡右移,促进了银氨络离子向银离子的转化,银离子和氢氧根离子反应生成氢氧化银,AgOH不稳定,水浴加热分解为黑色Ag2O.
(3)该同学对产生银镜的原因提出假设:可能是NaOH还原Ag2O.实验及现象:向AgNO3溶液中加入过量NaOH溶液,出现黑色沉淀,水浴加热,未出现银镜.
(4)重新假设:在NaOH存在下可能是NH3还原Ag2O.用如图1所示装置进行实验,现象:出现银镜.在虚线框内画出用生石灰和浓氨水制取NH3的装置简图(夹持仪器略).
(5)该同学认为在(4)的实验中会有Ag(NH3)2OH生成,由此又提出假设:在NaOH存在下,可能是Ag(NH3)2OH也参与了NH3还原Ag2O的反应.进行如图2实验:
①有部分Ag2O溶解在氨水中,该反应的化学方程式是Ag2O+4NH3•H2O=2Ag(NH3)2OH+3H2O.
②实验结果证实假设成立,依据的现象是与溶液接触的试管壁上析出银镜.
③用HNO3清洗试管壁上的Ag,该反应的化学方程式是2HNO3(浓)+Ag═AgNO3+2NO2↑+H2O.


 .写出E→F反应的化学方程式
.写出E→F反应的化学方程式 .
.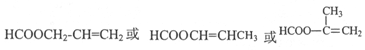 .
.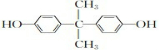 .
. 某稀硫酸和稀硝酸的混合溶液200mL,平均分成两份.向其中一份中逐渐加入铜粉,最多能溶解9.6g.向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如图所示 (已知硝酸只被还原为NO气体).
某稀硫酸和稀硝酸的混合溶液200mL,平均分成两份.向其中一份中逐渐加入铜粉,最多能溶解9.6g.向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如图所示 (已知硝酸只被还原为NO气体).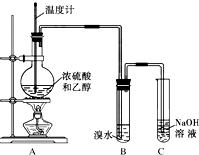 为探究乙烯的制取及乙烯和溴水反应的有关问题,甲、乙、丙三同学进行了如下实验活动,请你参与他们的活动并回答相关问题.
为探究乙烯的制取及乙烯和溴水反应的有关问题,甲、乙、丙三同学进行了如下实验活动,请你参与他们的活动并回答相关问题.