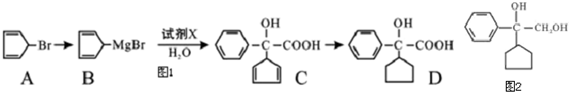
4. 已知:25℃时某些弱酸的电离平衡常数(如表),如图图象表示常温下,稀释CH3COOH、HClO两种酸的稀溶液时,溶液pH随加水量的变化,下列说法正确的是
已知:25℃时某些弱酸的电离平衡常数(如表),如图图象表示常温下,稀释CH3COOH、HClO两种酸的稀溶液时,溶液pH随加水量的变化,下列说法正确的是
( )
 已知:25℃时某些弱酸的电离平衡常数(如表),如图图象表示常温下,稀释CH3COOH、HClO两种酸的稀溶液时,溶液pH随加水量的变化,下列说法正确的是
已知:25℃时某些弱酸的电离平衡常数(如表),如图图象表示常温下,稀释CH3COOH、HClO两种酸的稀溶液时,溶液pH随加水量的变化,下列说法正确的是| CH3COOH | HClO | H2CO3 |
| Ka=1.8×10-5 | Ka=3.0×10-8 | Ka1=4.1×10-7 Ka2=4.7×10-11 |
| A. | 相同浓度CH3COONa和NaClO的混合液中,各离子浓度的大小关系是c(Na+)>c(ClO-)>c(CH3COO-)>c(OH-)>c(H+) | |
| B. | 向NaClO溶液中通入少量二氧化碳的离子方程式为:2ClO-+CO2+H2O═2HClO+CO32- | |
| C. | 图象中a、c两点处的溶液中$\frac{c(HR)×c(O{H}^{-})}{c({R}^{-})}$相等(HR代表CH3COOH或HClO) | |
| D. | 图象中a点酸的总浓度大于b点酸的总浓度 |
3.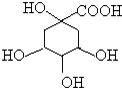 奎尼酸是制备艾滋病新药二咖啡酰奎尼酸的原料,其结构简式如图,下列有关奎尼酸的说法中正确的是( )
奎尼酸是制备艾滋病新药二咖啡酰奎尼酸的原料,其结构简式如图,下列有关奎尼酸的说法中正确的是( )
 奎尼酸是制备艾滋病新药二咖啡酰奎尼酸的原料,其结构简式如图,下列有关奎尼酸的说法中正确的是( )
奎尼酸是制备艾滋病新药二咖啡酰奎尼酸的原料,其结构简式如图,下列有关奎尼酸的说法中正确的是( )| A. | 奎尼酸的分子式是C7H9O6 | |
| B. | 1mol奎尼酸与足量NaOH溶液反应,最多消耗NaOH物质的量为5mol | |
| C. | 1 mol奎尼酸与足量钠反应生成56L氢气 | |
| D. | 奎尼酸能发生消去反应,也能与乙醇、乙酸发生取代反应 |
2.下列说法中,不正确的是( )
| A. | 短周期元素中,最外层电子数是其电子层数两倍的元素共有3种 | |
| B. | 第三周期元素的离子半径大小比较:S2->Cl->Na+>Mg2+>Al3+ | |
| C. | 日本核电站释放出的131I、132I和133I属于同素异形体 | |
| D. | 相同条件下,测定同浓度的Na2CO3溶液和Na2SO4溶液的pH,可比较C和S的非金属性强弱 |
19.设NA代表阿伏加德罗常数的数值,下列说法正确的是( )
| A. | 在标准状况下,22.4 L CH4与18 g H2O所含有的电子数均为10 NA | |
| B. | 3Fe+4H2O(g)$\frac{\underline{\;高温\;}}{\;}$Fe3O4+4H2反应中,当5.6 g Fe全部转化为Fe3O4时,则有0.3 NA电子发生转移 | |
| C. | 在1 L 0.1 mol/L碳酸钠溶液中阴离子总数等于0.1 NA | |
| D. | 12.4 g白磷中含有共价键数为0.4 NA |
18.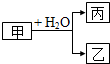 甲、乙、丙是常见的三种物质,它们之间有如图所示的转化关系.根据要求回答问题:
甲、乙、丙是常见的三种物质,它们之间有如图所示的转化关系.根据要求回答问题:
Ⅰ.已知:甲是常见单质,丙为氢气.
(1)若乙为氧化物且有磁性,则乙发生铝热反应的化学方程式为8Al+3Fe3O4$\frac{\underline{\;高温\;}}{\;}$4Al2O3+9Fe.
(2)若甲为碳,则产物乙、丙可合成甲醇.
①已知:CH4(g)+H2O(g)?CO(g)+3H2(g)△H=+206.0kJ•mol-1
CH4(g)+H2O(g)?CH3OH(g)+H2(g)△H=+77.0kJ•mol-1
写出气体乙与气体丙反应生成CH3OH(g)的热化学方程式:CO(g)+2H2(g)=CH3OH(g)△H=-129.0kJ•mol-1.
②乙和丙合成甲醇的反应在不同温度下的化学平衡常数(K)如下表.则T1< T2(填“>”“<”、“=”).
③乙可做某碱性燃料电池的燃料,该电池的负极反应式为CO-2e-+4OH-=CO32-+2H2O.
Ⅱ.已知:甲是由两种短周期元素组成的化合物,丙的水溶液显碱性.
(3)若构成甲的阴、阳离子个数比为2:3,丙是气体.则构成甲的阴、阳离子半径大小关系为N3->Mg2+(用具体的微粒表示).
(4)若乙是O2,则甲的一种重要用途是供氧剂或漂白剂;产物丙与Cl2按2:1(物质的量)反应得到丁溶液,丁溶液中阴离子浓度从大到小的顺序是c(Cl-)>c(ClO-)>C(OH-).
 甲、乙、丙是常见的三种物质,它们之间有如图所示的转化关系.根据要求回答问题:
甲、乙、丙是常见的三种物质,它们之间有如图所示的转化关系.根据要求回答问题:Ⅰ.已知:甲是常见单质,丙为氢气.
(1)若乙为氧化物且有磁性,则乙发生铝热反应的化学方程式为8Al+3Fe3O4$\frac{\underline{\;高温\;}}{\;}$4Al2O3+9Fe.
(2)若甲为碳,则产物乙、丙可合成甲醇.
①已知:CH4(g)+H2O(g)?CO(g)+3H2(g)△H=+206.0kJ•mol-1
CH4(g)+H2O(g)?CH3OH(g)+H2(g)△H=+77.0kJ•mol-1
写出气体乙与气体丙反应生成CH3OH(g)的热化学方程式:CO(g)+2H2(g)=CH3OH(g)△H=-129.0kJ•mol-1.
②乙和丙合成甲醇的反应在不同温度下的化学平衡常数(K)如下表.则T1< T2(填“>”“<”、“=”).
| 温度/℃ | T1 | T2 |
| K | 2.041 | 0.012 |
Ⅱ.已知:甲是由两种短周期元素组成的化合物,丙的水溶液显碱性.
(3)若构成甲的阴、阳离子个数比为2:3,丙是气体.则构成甲的阴、阳离子半径大小关系为N3->Mg2+(用具体的微粒表示).
(4)若乙是O2,则甲的一种重要用途是供氧剂或漂白剂;产物丙与Cl2按2:1(物质的量)反应得到丁溶液,丁溶液中阴离子浓度从大到小的顺序是c(Cl-)>c(ClO-)>C(OH-).
16.下列反应的离子方程式正确的是( )
0 170762 170770 170776 170780 170786 170788 170792 170798 170800 170806 170812 170816 170818 170822 170828 170830 170836 170840 170842 170846 170848 170852 170854 170856 170857 170858 170860 170861 170862 170864 170866 170870 170872 170876 170878 170882 170888 170890 170896 170900 170902 170906 170912 170918 170920 170926 170930 170932 170938 170942 170948 170956 203614
| A. | NaAlO2溶液中通入过量的CO2:2AlO2-+3H2O+CO2═2Al(OH)3↓+CO32- | |
| B. | 明矾溶液中滴加Ba(OH)2溶液至SO42-完全沉淀:Al3++Ba2++SO42-+3OH-═BaSO4↓+Al(OH)3↓ | |
| C. | 200 mL 2 mol/L的FeBr2溶液中通入11.2 L标准状况下的氯气:4Fe2++6Br-+5Cl2═4Fe3++3Br2+10Cl- | |
| D. | 在强碱溶液中次氯酸钠与Fe(OH)3反应生成Na2FeO4:3ClO-+2Fe(OH)3═2FeO42-+3Cl-+H2O+4H+ |
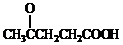 )合成聚芳酯E的路线:
)合成聚芳酯E的路线: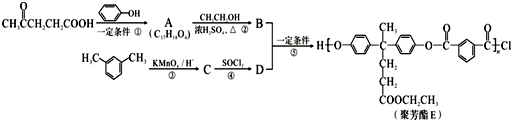
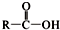 +SOCl2→
+SOCl2→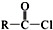 +SO2+HCl
+SO2+HCl +R′OH→
+R′OH→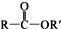 +HCl (R、R′表示烃基)
+HCl (R、R′表示烃基)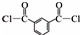 .
.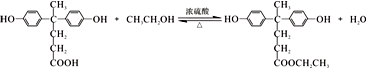 .
. 结构
结构 .
.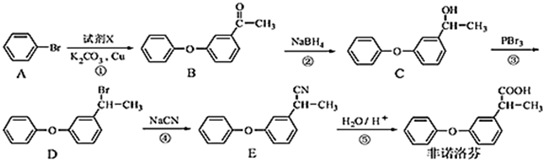
 .
. .
.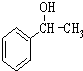 为原料制备
为原料制备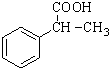 的合成路线流程图(无机试剂任用).合成路线流程图示例如下:CH3CH2Br$→_{△}^{NaOH溶液}$CH3CH2OH$→_{浓硫酸,△}^{CH_{3}COOH}$CH3COOCH2CH3.
的合成路线流程图(无机试剂任用).合成路线流程图示例如下:CH3CH2Br$→_{△}^{NaOH溶液}$CH3CH2OH$→_{浓硫酸,△}^{CH_{3}COOH}$CH3COOCH2CH3.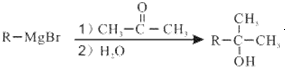 合成线路中X(分子式为C8H6O3)的结构简式为
合成线路中X(分子式为C8H6O3)的结构简式为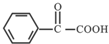 ;
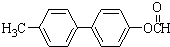
;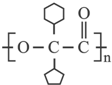 ;
;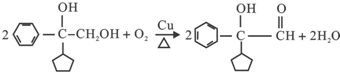 .
.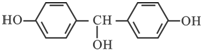 .
.