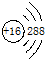题目内容
18.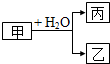 甲、乙、丙是常见的三种物质,它们之间有如图所示的转化关系.根据要求回答问题:
甲、乙、丙是常见的三种物质,它们之间有如图所示的转化关系.根据要求回答问题:Ⅰ.已知:甲是常见单质,丙为氢气.
(1)若乙为氧化物且有磁性,则乙发生铝热反应的化学方程式为8Al+3Fe3O4$\frac{\underline{\;高温\;}}{\;}$4Al2O3+9Fe.
(2)若甲为碳,则产物乙、丙可合成甲醇.
①已知:CH4(g)+H2O(g)?CO(g)+3H2(g)△H=+206.0kJ•mol-1
CH4(g)+H2O(g)?CH3OH(g)+H2(g)△H=+77.0kJ•mol-1
写出气体乙与气体丙反应生成CH3OH(g)的热化学方程式:CO(g)+2H2(g)=CH3OH(g)△H=-129.0kJ•mol-1.
②乙和丙合成甲醇的反应在不同温度下的化学平衡常数(K)如下表.则T1< T2(填“>”“<”、“=”).
| 温度/℃ | T1 | T2 |
| K | 2.041 | 0.012 |
Ⅱ.已知:甲是由两种短周期元素组成的化合物,丙的水溶液显碱性.
(3)若构成甲的阴、阳离子个数比为2:3,丙是气体.则构成甲的阴、阳离子半径大小关系为N3->Mg2+(用具体的微粒表示).
(4)若乙是O2,则甲的一种重要用途是供氧剂或漂白剂;产物丙与Cl2按2:1(物质的量)反应得到丁溶液,丁溶液中阴离子浓度从大到小的顺序是c(Cl-)>c(ClO-)>C(OH-).
分析 Ⅰ甲、乙、丙是常见的三种物质,甲是常见单质,丙为氢气,
(1)若乙为氧化物且有磁性,则甲为铁,乙为四氧化三铁;
(2)若甲为碳,产物乙、丙可合成甲醇,则乙为一氧化碳,根据盖斯定律确定热化学方程式,根据平衡常数与温度的关系判断反应中的热效应,根据原电池原理写负极反应式;
Ⅱ甲是由两种短周期元素组成的化合物,丙的水溶液显碱性,
(3)若构成甲的阴、阳离子个数比为2:3,丙是气,则甲为氮化镁,丙为氨气,乙为氢氧化镁;
(4)若乙是O2,则甲为过氧化钠,丙为氢氧化钠,氢氧化钠与氯气按2:1反应生成氯化钠和次氯酸钠溶液.
解答 解:Ⅰ甲、乙、丙是常见的三种物质,甲是常见单质,丙为氢气,
(1)若乙为氧化物且有磁性,则甲为铁,乙为四氧化三铁,则乙发生铝热反应的化学方程式为8Al+3Fe3O4$\frac{\underline{\;高温\;}}{\;}$4Al2O3+9Fe,
故答案为:8Al+3Fe3O4$\frac{\underline{\;高温\;}}{\;}$4Al2O3+9Fe;
(2)若甲为碳,产物乙、丙可合成甲醇,则乙为一氧化碳,
①根据①CH4(g)+H2O(g)?CO(g)+3H2(g)△H=+206.0kJ•mol-1;②CH4(g)+H2O(g)?CH3OH(g)+H2(g)△H=+77.0kJ•mol-1,利用盖斯定律可知,用②-①得合成甲醇的热化学方程式为CO(g)+2H2(g)=CH3OH(g)△H=+77.0kJ•mol-1-206.0kJ•mol-1=-129.0kJ•mol-1,
故答案为:CO(g)+2H2(g)=CH3OH(g)△H=-129.0kJ•mol-1;
②根据平衡常数与温度的关系可知,由于上述反应为放热反应,升高温度平衡逆向移动,因为K1>K2,所以T1<T2,
故答案为:<;
③一氧化碳做某碱性燃料电池的燃料,则CO作还原剂在负极发生氧化反应,根据原电池原理负极反应式为CO-2e-+4OH-=CO32-+2H2O,
故答案为:CO-2e-+4OH-=CO32-+2H2O;
Ⅱ甲是由两种短周期元素组成的化合物,丙的水溶液显碱性,
(3)若构成甲的阴、阳离子个数比为2:3,丙是气,则甲为氮化镁,丙为氨气,乙为氢氧化镁,构成甲的阴、阳离子半径大小关系为N3->Mg2+,
故答案为:N3->Mg2+;
(4)若乙是O2,则甲为过氧化钠,可作为供氧剂或漂白剂,丙为氢氧化钠,氢氧化钠与氯气按2:1反应生成氯化钠和次氯酸钠溶液,该溶液中阴离子浓度从大到小的顺序是c(Cl-)>c(ClO-)>C(OH-),
故答案为:供氧剂或漂白剂;c(Cl-)>c(ClO-)>C(OH-).
点评 本题考查无机物的推断,题目难度中等,本题注意根据物质的特性为突破口,根据各物质的转化关系进行推断,学习中注重相关基础知识的积累.

已知:2CH3CHO+O2$→_{△}^{催化剂}$2CH3COOH
(1)反应II的化学方程式是2CH3CH2OH+O2$→_{△}^{Cu}$2CH3CHO+2H2O.
(2)D为高分子化合物,可以用来制造多种包装材料,其结构简式是
 .
.(3)E是有香味的物质,在实验室用图2装置制取.
①反应IV的化学方程式是CH3COOH+HOCH2CH3
 CH3COOCH2CH3+H2O,该反应类型为酯化反应或取代反应.
CH3COOCH2CH3+H2O,该反应类型为酯化反应或取代反应.②该装置图中有一个明显的错误是导气管的出口伸入到饱和碳酸钠溶液液面以下.
(4)为了证明浓硫酸在反应IV中起到了催化剂和吸水剂的作用,某同学利用上图改进后装置进行了以下4个实验.实验开始先用酒精灯微热3min,再加热使之微微沸腾3min.实验结束后充分振荡小试管乙再测有机层的厚度,实验记录如下:
| 实验编号 | 试管甲中试剂 | 试管乙中试剂 | 有机层的厚度/cm |
| A | 2mL乙醇、1mL乙酸、 1mL18mol•L-1 浓硫酸 | 饱和Na2CO3溶液 | 3.0 |
| B | 2mL乙醇、1mL乙酸 | 0.1 | |
| C | 2mL乙醇、1mL乙酸、 3mL 2mol•L-1 H2SO4 | 0.6 | |
| D | 2mL乙醇、1mL乙酸、盐酸 | 0.6 |
②分析实验AC(填实验编号)的数据,可以推测出浓H2SO4的吸水性提高了乙酸乙酯的产率.

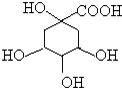 奎尼酸是制备艾滋病新药二咖啡酰奎尼酸的原料,其结构简式如图,下列有关奎尼酸的说法中正确的是( )
奎尼酸是制备艾滋病新药二咖啡酰奎尼酸的原料,其结构简式如图,下列有关奎尼酸的说法中正确的是( )| A. | 奎尼酸的分子式是C7H9O6 | |
| B. | 1mol奎尼酸与足量NaOH溶液反应,最多消耗NaOH物质的量为5mol | |
| C. | 1 mol奎尼酸与足量钠反应生成56L氢气 | |
| D. | 奎尼酸能发生消去反应,也能与乙醇、乙酸发生取代反应 |
| A. | 乙烯使溴水褪色;乙烯使酸性高锰酸钾溶液褪色 | |
| B. | 苯与液溴混合后加入铁粉;光照甲烷与氯气的混合气体 | |
| C. | 苯与氢气在镍作催化剂的条件下反应;乙烯与水反应制乙醇 | |
| D. | 乙醇使酸性高锰酸钾溶液褪色;乙醇使酸性重铬酸钾溶液变色 |
| A. | 某溶液中加入BaCl2溶液,产生不溶于稀盐酸的白色沉淀,则该溶液一定含有SO42- | |
| B. | FeCl3稀溶液与Fe(OH)3胶体本质区别是分散质粒子的大小 | |
| C. | Fe(OH)3胶体可以产生电泳现象,由此可知Fe(OH)3胶体溶液带电 | |
| D. | 用溶解、过滤的方法分离KNO3和NaCl固体的混合物 |

 用二氧化氯(ClO2)、铁酸钠(Na2FeO4摩尔质量为166g•mol-1)等新型净水剂替代传统的净水剂Cl2对淡水进行消毒是城市饮用水处理新技术.ClO2和Na2FeO4在水处理过程中分别被还原为Cl-和Fe3+.
用二氧化氯(ClO2)、铁酸钠(Na2FeO4摩尔质量为166g•mol-1)等新型净水剂替代传统的净水剂Cl2对淡水进行消毒是城市饮用水处理新技术.ClO2和Na2FeO4在水处理过程中分别被还原为Cl-和Fe3+.