18.下列离子方程式中,正确的是( )
| A. | 稀硫酸与氢氧化钡溶液反应:H++OH-═H2O | |
| B. | 铁与氯化铁溶液反应:Fe+2Fe3+═3Fe2+ | |
| C. | 实验室制氯气:MnO2+4HCl═Mn2++2Cl-+Cl2↑+2H2O | |
| D. | 向氯化铝溶液滴加少量氨水:Al3++3OH-═Al(OH)3↓ |
17.下列关于硅酸盐材料的说法错误的是( )
| A. | 生活中常见的硅酸盐材料有玻璃、水泥、陶瓷 | |
| B. | 生产陶瓷的主要原料是黏土 | |
| C. | 普通玻璃的主要成份只有SiO2 | |
| D. | 硅酸盐水泥以石灰石和黏土为主要原料生产 |
16.天文科学家研究证明,组成太阳的气体中存在20Ne和22Ne.下列关于20Ne和22Ne的说法正确的是( )
| A. | 20Ne和22Ne互为同位素 | B. | 20Ne和22Ne的电子数不同 | ||
| C. | 20Ne和22Ne的质量数相同 | D. | 20Ne和22Ne的中子数相同 |
15.下列有关物质用途的说法错误的是( )
| A. | 可用铝槽密闭盛装浓硫酸 | |
| B. | 工业上利用蛋白质的水解反应生产肥皂和甘油 | |
| C. | 乙醇可用作汽车燃料 | |
| D. | 食醋可用于消除暖水瓶中的水垢 |
14.设NA为阿伏加德罗常数的值.下列说法正确的是( )
| A. | 标准状况下,22.4 LH2O中含有的分子数为NA | |
| B. | 1mol•L-1Na2CO3溶液中含有的钠离子数为2NA | |
| C. | 28gN2中含有的原子数为NA | |
| D. | 1molMg与足量稀盐酸反应,转移的电子数为2NA |
13.苹果和香蕉中都含有一种具有香味的分子式为C10H20O2的物质,它属于( )
0 170711 170719 170725 170729 170735 170737 170741 170747 170749 170755 170761 170765 170767 170771 170777 170779 170785 170789 170791 170795 170797 170801 170803 170805 170806 170807 170809 170810 170811 170813 170815 170819 170821 170825 170827 170831 170837 170839 170845 170849 170851 170855 170861 170867 170869 170875 170879 170881 170887 170891 170897 170905 203614
| A. | 单质 | B. | 氧化物 | C. | 盐 | D. | 有机物 |
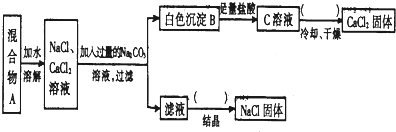
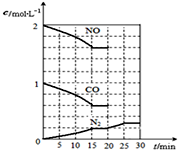 随着大气污染的日趋严重,国家拟于“十二五”期间,将二氧化硫(SO2)排放量减少8%,氮氧化物(NOx)排放量减少10%.目前,消除大气污染有多种方法.
随着大气污染的日趋严重,国家拟于“十二五”期间,将二氧化硫(SO2)排放量减少8%,氮氧化物(NOx)排放量减少10%.目前,消除大气污染有多种方法.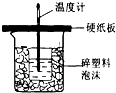 中和热是指酸跟碱发生中和反应生成lmolH2O所放出的热量.某学生想通过测反应过程中所放出的热量来计算中和热.他将50mL0.5mol/L的盐酸与50mL0.55mol/L的NaOH溶液在如图所示的装置中进行中和反应.请回答下列问题:
中和热是指酸跟碱发生中和反应生成lmolH2O所放出的热量.某学生想通过测反应过程中所放出的热量来计算中和热.他将50mL0.5mol/L的盐酸与50mL0.55mol/L的NaOH溶液在如图所示的装置中进行中和反应.请回答下列问题: