题目内容
12.某学生设计了如下实验: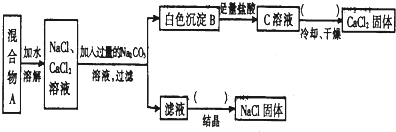
回答下列问题:
(1)该同学的实验目的是分离氯化钙和氯化钠固体;
(2)上图括号内的操作步骤均为蒸发;
(3)按此实验方案得到的NaCl固体中肯定含有Na2CO3(填化学式)杂质,为了解决这个问题可以向过滤得到的滤液中加入适量的稀盐酸(填名称).
(4)写出生成B的化学方程式CaCl2+Na2CO3=CaCO3↓+2NaCl.
分析 由分离流程可知,溶解后加过量碳酸钠,生成碳酸钙沉淀,则白色沉淀B为碳酸钙,B与盐酸反应生成氯化钙,C为氯化钙溶液,在HCl气流中蒸发、冷却、过滤得到氯化钙固体;滤液中含NaCl、碳酸钠,加足量盐酸反应后,蒸发结晶得到NaCl固体,以此来解答.
解答 解:由分离流程可知,溶解后加过量碳酸钠,生成碳酸钙沉淀,则白色沉淀B为碳酸钙,B与盐酸反应生成氯化钙,C为氯化钙溶液,在HCl气流中蒸发、冷却、过滤得到氯化钙固体;因碳酸钠过量,滤液中含NaCl、碳酸钠,加足量盐酸反应后,蒸发结晶得到NaCl固体,
(1)由上述分析可知,原为固体混合物,实验可分离二者,则实验目的为分离CaCl2和NaCl两种固体混合物,故答案为:分离CaCl2和NaCl两种固体混合物;
(2)由上述分析可知,括号内的操作均为蒸发,故答案为:蒸发;
(3)由上述分析可知,NaCl固体中肯定含有Na2CO3,应加适量的稀盐酸反应后蒸发,故答案为:Na2CO3;稀盐酸;
(4)碳酸钠与氯化钙反应生成碳酸钙沉淀,化学方程式:CaCl2+Na2CO3=CaCO3↓+2NaCl,故答案为:CaCl2+Na2CO3=CaCO3↓+2NaCl.
点评 本题考查混合物分离提纯方法及综合应用,为高频考点,把握实验流程中发生的反应、混合物分离方法等为解答的关键,侧重分析与实验能力的考查,题目难度不大.

练习册系列答案
 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案
相关题目
9.下列离子方程式正确的是( )
| A. | 铁与稀硫酸反应:2Fe+6H+→2Fe3++3H2↑ | |
| B. | Al与稀H2SO4:Al+2H+→Al3++H2↑ | |
| C. | 偏铝酸钠溶液中加过量HCl:AlO2-+4H+=Al3++2H2O | |
| D. | 氯化铝溶液中加氨水:Al3++3OH-→Al(OH)3↓ |
7.分别放在0.1mol•L-1H2SO4溶液中的四块相同的纯锌片,其腐蚀速率由快到慢的顺序是( )


| A. | ④>③>②>① | B. | ③>①>②>④ | C. | ④>③>①>② | D. | ②>③>④>① |
17.下列关于硅酸盐材料的说法错误的是( )
| A. | 生活中常见的硅酸盐材料有玻璃、水泥、陶瓷 | |
| B. | 生产陶瓷的主要原料是黏土 | |
| C. | 普通玻璃的主要成份只有SiO2 | |
| D. | 硅酸盐水泥以石灰石和黏土为主要原料生产 |
1.下列叙述中,错误的是( )
| A. | 1mol的任何气体中都含有6.02×1023个分子 | |
| B. | 12g12C中含有6.02×1023个碳原子 | |
| C. | 1mol水中含有6.02×1023个氢原子 | |
| D. | 物质的量相等的CO和CO2所含的C原子个数也相等 |
2.氯化铜的水溶液为淡蓝色,当加入浓盐酸后,溶液就变成黄绿色,这种颜色的变化是由下列可逆反应引起的:
[Cu(H2O)4]2+(淡蓝色)+4Cl-?[CuCl4]2-(黄绿色)+4H2O,下列方法能使溶液变成淡蓝色的是( )
[Cu(H2O)4]2+(淡蓝色)+4Cl-?[CuCl4]2-(黄绿色)+4H2O,下列方法能使溶液变成淡蓝色的是( )
| A. | 加压 | B. | 加入NaCl溶液 | C. | 加AgNO3溶液 | D. | 加盐酸 |

 →
→ +HBr.
+HBr. )是一种医药中间体.请设计合理方案用茴香醛(
)是一种医药中间体.请设计合理方案用茴香醛( )合成D(其他原料自选,用反应流程图表示,并注明必要的反应条件).
)合成D(其他原料自选,用反应流程图表示,并注明必要的反应条件).