20.下列说法不正确的是( )
| A. | 浓硝酸常显黄色的原因是浓硝酸中溶有少量NO2 | |
| B. | 氯水和二氧化硫都能使品红溶液褪色 | |
| C. | 漂白粉长期暴露在空气中会变质 | |
| D. | 蔗糖中加入浓硫酸固体颜色变黑,说明浓硫酸具有吸水性 |
16.下列含有极性键的非极性分子是( )
①CCl4 ②NH3 ③CH4 ④CO2 ⑤N2 ⑥H2S ⑦SO2 ⑧CS2 ⑨H2O ⑩HF.
①CCl4 ②NH3 ③CH4 ④CO2 ⑤N2 ⑥H2S ⑦SO2 ⑧CS2 ⑨H2O ⑩HF.
| A. | ②③④⑤⑧ | B. | ①③④⑤⑧ | C. | ①③④⑧ | D. | 以上均不对 |
15.下列各项叙述中,正确的是( )
| A. | H2O分子的中心原子形成sp2杂化轨道 | |
| B. | 在同一电子层上运动的电子,其自旋方向肯定不同 | |
| C. | 镁原子由1s22s22p63s2→1s22s22p63p2时,原子吸收能量,由基态转化成激发态 | |
| D. | 原子最外层电子排布是5s1的元素,其氢氧化物不能使氢氧化铝溶解 |
14.在花瓶中加入“鲜花保鲜剂”,能延长鲜花的寿命.下表是1L“鲜花保鲜剂”中含有的成分,阅读后回答下列问题:
(1)下列“鲜花保鲜剂”的成分中,属于非电解质的是A.
A、蔗糖 B、硫酸钾 C、高锰酸钾 D、硝酸银
(2)“鲜花保鲜剂”中K+(阿司匹林中不含K+)的物质的量浓度为$\frac{0.50}{158}+\frac{2×0.50}{174}$ L•mol-1.(只要求写出计算表达式,不需要计算结果)
(3)配制上述1L“鲜花保鲜剂”所需的仪器有:1000mL容量瓶、烧杯、玻璃棒、药匙、胶头滴管、托盘天平.(在横线上填写所缺仪器的名称)
(4)在溶液配制过程中,下列操作对配制结果没有影响的是BD.
A、将药品放入容量瓶中加蒸馏水溶解
B、容量瓶在使用前未干燥,里面有少量蒸馏水
C、容量瓶在使用前刚刚配制完一定物质的量浓度的NaCl溶液而未洗净
D、定容摇匀后发现液面低于容量瓶的刻度线,但未做任何处理.
0 170609 170617 170623 170627 170633 170635 170639 170645 170647 170653 170659 170663 170665 170669 170675 170677 170683 170687 170689 170693 170695 170699 170701 170703 170704 170705 170707 170708 170709 170711 170713 170717 170719 170723 170725 170729 170735 170737 170743 170747 170749 170753 170759 170765 170767 170773 170777 170779 170785 170789 170795 170803 203614
| 成分 | 质量(g) | 摩尔质量(g•mol-1) |
| 蔗糖 | 50.00 | 342 |
| 硫酸钾 | 0.50 | 174 |
| 阿司匹林 | 0.35 | 180 |
| 高锰酸钾 | 0.50 | 158 |
| 硝酸银 | 0.04 | 170 |
A、蔗糖 B、硫酸钾 C、高锰酸钾 D、硝酸银
(2)“鲜花保鲜剂”中K+(阿司匹林中不含K+)的物质的量浓度为$\frac{0.50}{158}+\frac{2×0.50}{174}$ L•mol-1.(只要求写出计算表达式,不需要计算结果)
(3)配制上述1L“鲜花保鲜剂”所需的仪器有:1000mL容量瓶、烧杯、玻璃棒、药匙、胶头滴管、托盘天平.(在横线上填写所缺仪器的名称)
(4)在溶液配制过程中,下列操作对配制结果没有影响的是BD.
A、将药品放入容量瓶中加蒸馏水溶解
B、容量瓶在使用前未干燥,里面有少量蒸馏水
C、容量瓶在使用前刚刚配制完一定物质的量浓度的NaCl溶液而未洗净
D、定容摇匀后发现液面低于容量瓶的刻度线,但未做任何处理.
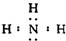 ,化学键类型为共价键;
,化学键类型为共价键;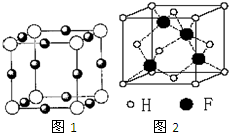 已知A、B、C、D、E、F都是周期表中前四周期的元素,它们的核电荷数A<B<C<D<E<F.其中A原子核外有三个未成对电子;化合物B2E的晶体为离子晶体,E原子核外的M层中只有两对成对电子;C元素是地壳中含量最高的金属元素;D单质的晶体类型在同周期的单质中没有相同的;F原子核外最外层电子数与B相同,其余各层电子均充满.请根据以上信息,回答下列问题:(答题时,A、B、C、D、E、F用所对应的元素符号表示)
已知A、B、C、D、E、F都是周期表中前四周期的元素,它们的核电荷数A<B<C<D<E<F.其中A原子核外有三个未成对电子;化合物B2E的晶体为离子晶体,E原子核外的M层中只有两对成对电子;C元素是地壳中含量最高的金属元素;D单质的晶体类型在同周期的单质中没有相同的;F原子核外最外层电子数与B相同,其余各层电子均充满.请根据以上信息,回答下列问题:(答题时,A、B、C、D、E、F用所对应的元素符号表示)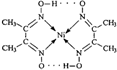 由于受3d电子的影响,元素周期表中第四周期过渡元素的明显特征是形成多种多样的配合物.
由于受3d电子的影响,元素周期表中第四周期过渡元素的明显特征是形成多种多样的配合物.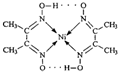 分子内的作用力没有B (填编号).
分子内的作用力没有B (填编号).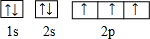 ,这样的排布遵循了泡利原理和洪特规则.
,这样的排布遵循了泡利原理和洪特规则.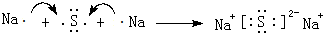 .
.