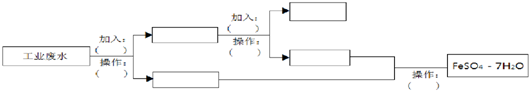
题目内容
15.下列各项叙述中,正确的是( )| A. | H2O分子的中心原子形成sp2杂化轨道 | |
| B. | 在同一电子层上运动的电子,其自旋方向肯定不同 | |
| C. | 镁原子由1s22s22p63s2→1s22s22p63p2时,原子吸收能量,由基态转化成激发态 | |
| D. | 原子最外层电子排布是5s1的元素,其氢氧化物不能使氢氧化铝溶解 |
分析 A.根据价层电子对互斥理论确定原子杂化方式,价层电子对个数=σ键个数+孤电子对个数,σ键个数=配原子个数,孤电子对个数=$\frac{1}{2}$×(a-xb),a指中心原子价电子个数,x指配原子个数,b指配原子形成稳定结构需要的电子个数,据此判断杂质类型;
B.在同一电子层上运动的电子,如不在同一轨道,则自旋方向可能相同;
C.由基态成为激发态,吸收能量;
D.原子最外层电子排布是5s1的元素,为Rb,对应的碱为强碱,可与氢氧化铝反应.
解答 解:A.H2O中O原子的价层电子对个数=2+$\frac{1}{2}$(6-2×1)=4,所以O原子采用sp3杂化,故A错误;
B.在同一电子层上运动的电子,如不在同一轨道,则自旋方向可能相同,如2p3,故B错误;
C.由基态成为激发态,吸收能量,故C正确;
D.氢氧化铝与强碱反应生成偏铝酸盐,原子最外层电子排布是5s1的元素,为Rb,对应的碱为强碱,可与氢氧化铝反应,故D错误;
故选C.
点评 本题考查原子的杂化类型以及原子核外电子的排布,题目难度中等,本题注意把握原子核外电子的排布规律以及元素周期的递变规律.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
20.下列说法不正确的是( )
| A. | 浓硝酸常显黄色的原因是浓硝酸中溶有少量NO2 | |
| B. | 氯水和二氧化硫都能使品红溶液褪色 | |
| C. | 漂白粉长期暴露在空气中会变质 | |
| D. | 蔗糖中加入浓硫酸固体颜色变黑,说明浓硫酸具有吸水性 |
5.下列离子在溶液中因发生氧化还原反应而不能大量共存的是( )
| A. | Ag+、NO3-、Cl-、K+ | B. | Cu2+、NH4+、Br-、OH- | ||
| C. | H+、NO3-、Fe2+、Na+ | D. | K+、Ba2+、OH-、SO42- |
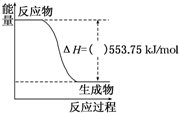 2011年深圳大运会“虹”火炬采用丙烷为燃料.丙烷热值较高,污染较小,是一种优良的燃料.试回答下列问题:
2011年深圳大运会“虹”火炬采用丙烷为燃料.丙烷热值较高,污染较小,是一种优良的燃料.试回答下列问题: