3.已知含有电解质的凝胶具有导电性,铝镍胶体电池是一种正在开发的二次高能电池,放电时总反应为2Al+3Ni2O3+9H2O═2Al(OH)3+6Ni(OH)2.下列有关该电池的说法正确的是( )
| A. | 此电池的正极为Ni2O3,电池中的凝胶呈弱酸性 | |
| B. | 放电时,负极反应式为Al+3H2O-3e-═Al(OH)3+3H+ | |
| C. | 电池充电过程中,阳极附近溶液的pH升高 | |
| D. | 充电时,外接直流电源负极与铝镍胶体电池铝电极相连 |
2.下列叙述正确的是( )
①久置于空气中的氢氧化钠溶液,加盐酸时有气体产生 ②浓硫酸可用于干燥氢气、碘化氢等气体,但不能干燥氨气、二氧化氮气体 ③Na2O2与水反应,红热的Fe与水蒸气反应均能生成碱 ④玻璃、水泥、水晶项链都是硅酸盐制品 ⑤浓硫酸与铜反应既体现了其强氧化性又体现了其酸性 ⑥氢氧化铁胶体与氯化铁溶液分别蒸干灼烧得到相同的物质.
①久置于空气中的氢氧化钠溶液,加盐酸时有气体产生 ②浓硫酸可用于干燥氢气、碘化氢等气体,但不能干燥氨气、二氧化氮气体 ③Na2O2与水反应,红热的Fe与水蒸气反应均能生成碱 ④玻璃、水泥、水晶项链都是硅酸盐制品 ⑤浓硫酸与铜反应既体现了其强氧化性又体现了其酸性 ⑥氢氧化铁胶体与氯化铁溶液分别蒸干灼烧得到相同的物质.
| A. | ①④⑤ | B. | ①⑤⑥ | C. | ②③④ | D. | ④⑤⑥ |
1.实验室中需要配制2mol/L的NaCl溶液950mL,配制时应选用的容量瓶的规格和称取的NaCl的质量分别是
( )
( )
| A. | 950 mL 111.2 g | B. | 500 mL 117.0 g | ||
| C. | 1000 mL 117.0 g | D. | 1000 mL 111.2 g |
20.有机化合物M的结构简式如图所示,有关化合物M的叙述正确的是( )
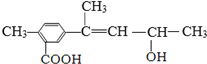
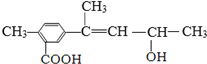
| A. | M的分子式为C13H18O3 | |
| B. | M一定条件下,可以发生加成、酯化、水解等反应 | |
| C. | 1mol M与足量金属钠反应,可生成标准状况下的H211.2 L | |
| D. | 1mol M最多能与4mol H2发生加成反应 |
19.下列物质中所有原子均满足最外层8电子稳定结构的化合物是( )
| A. | PCl5 | B. | P4 | C. | CCl4 | D. | NH3 |
18.C、N、O、Al、Si、Cl、Fe是七种常见元素
(1)N元素位于周期表第二周期,第ⅤA族,C元素的一种同位素可测定文物年代,这种同位素的符号是146C.
(2)用“>”、“<”或“=”填空:
(3)SiO2及硅酸盐在自然界广泛存在,在日常生活、生产、科研及新型材料等方面有着重要的用途.高岭土[Al2(Si2O5)(OH)4]改写成氧化物的形式为Al2O3•2SiO2•2H2O.
(4)ClO2常用于水的净化,工业上可用Cl2氧化NaClO2溶液制取ClO2.写出该反应的离子方程式,并用单线桥标出电子转移的方向和数目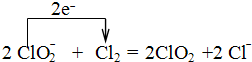 .
.
(5)将铝片(表面除去氧化膜)与碳棒用导线连接后插入稀NaOH溶液中可以构成原电池,电池正极为碳棒,电池负极反应的电极方程式为Al-3e-+4OH-=AlO2-+2H2O.
(1)N元素位于周期表第二周期,第ⅤA族,C元素的一种同位素可测定文物年代,这种同位素的符号是146C.
(2)用“>”、“<”或“=”填空:
| 离子半径 | 得电子能力 | 酸性 | 金属性 |
| O2->Al3+ | 16O=18O | H2CO3<HNO3 | Fe<Al |
(4)ClO2常用于水的净化,工业上可用Cl2氧化NaClO2溶液制取ClO2.写出该反应的离子方程式,并用单线桥标出电子转移的方向和数目
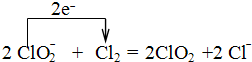 .
.(5)将铝片(表面除去氧化膜)与碳棒用导线连接后插入稀NaOH溶液中可以构成原电池,电池正极为碳棒,电池负极反应的电极方程式为Al-3e-+4OH-=AlO2-+2H2O.
17.下列离子方程式错误的是( )
| A. | Ba(OH)2溶液中滴加稀硫酸:Ba2++2OH-+2H++SO42-═BaSO4↓+2H2O | |
| B. | 将少量铜屑放入浓硝酸中:Cu+4H++2NO3-═Cu2++2NO2↑+2H2O | |
| C. | 过量的二氧化碳通入“水玻璃”中:CO2+SiO32-+H2O═CO32-+H2SiO3↓ | |
| D. | Cl2通入NaOH稀溶液中:Cl2+2OH-═Cl-+ClO-+H2O |
16.已知A、B、C、D、E是短周期中原子序数依次增大的5种主族元素,其中元素A、E的单质在常温下呈气态,元素B的原子最外层电子数是其电子层数的2倍,元素C在同周期的主族元素中原子半径最大,元素D的合金是日常生活中常用的金属材料.下列说法正确的是( )
| A. | 元素A、B组成的化合物常温下不一定呈气态 | |
| B. | 元素C、D的最高价氧化物对应的水化物之间不能发生反应 | |
| C. | 化合物AE与CE含有相同类型的化学键 | |
| D. | 工业上常用电解法电解熔融的DE3制备元素D的单质 |
15.某有机物的结构简式为:HO-CH2-CH═CH-COOH,现有①氯化氢、②溴水、③纯碱溶液、④乙醇、⑤酸性高锰酸钾溶液,试根据该有机物的结构特点,判断在一定条件下,能与其反应的物质是( )
| A. | 只有②④⑤ | B. | 只有①③④ | C. | 只有①②③⑤ | D. | ①②③④⑤ |
14.有机物分子中原子间(或原子与原子团间)的相互影响会导致物质化学性质的不同.下列各项的事实不能说明上述观点的是( )
0 170595 170603 170609 170613 170619 170621 170625 170631 170633 170639 170645 170649 170651 170655 170661 170663 170669 170673 170675 170679 170681 170685 170687 170689 170690 170691 170693 170694 170695 170697 170699 170703 170705 170709 170711 170715 170721 170723 170729 170733 170735 170739 170745 170751 170753 170759 170763 170765 170771 170775 170781 170789 203614
| A. | 甲苯能使酸性高锰酸钾溶液褪色,而甲烷不能使酸性高锰酸钾溶液褪色 | |
| B. | 乙基对羟基的影响,使羟基的活性变弱,电离H+的能力不及H2O | |
| C. | 相等物质的量的甘油和乙醇分别与足量金属钠反应,甘油产生的H2多 | |
| D. | 苯酚中的羟基氢能与NaOH溶液反应,而醇羟基氢不能与NaOH溶液反应 |