题目内容
16.已知A、B、C、D、E是短周期中原子序数依次增大的5种主族元素,其中元素A、E的单质在常温下呈气态,元素B的原子最外层电子数是其电子层数的2倍,元素C在同周期的主族元素中原子半径最大,元素D的合金是日常生活中常用的金属材料.下列说法正确的是( )| A. | 元素A、B组成的化合物常温下不一定呈气态 | |
| B. | 元素C、D的最高价氧化物对应的水化物之间不能发生反应 | |
| C. | 化合物AE与CE含有相同类型的化学键 | |
| D. | 工业上常用电解法电解熔融的DE3制备元素D的单质 |
分析 A、B、C、D、E是短周期中原子序数依次增大的5种主族元素,元素C在同周期的主族元素中原子半径最大,处于IA族,元素B的原子最外层电子数是其电子层数的2倍,B的原子序数小于C,B有2个电子层,最外层电子数为4,故B为C元素,C为Na;元素D的合金是日常生活中常用的金属材料,则D为Al;其中元素A、E的单质在常温下呈气态,A的原子序数小于碳元素,A为H元素,E的原子序数大于铝元素,E为Cl元素.
解答 解:A、B、C、D、E是短周期中原子序数依次增大的5种主族元素,元素C在同周期的主族元素中原子半径最大,处于IA族,元素B的原子最外层电子数是其电子层数的2倍,B的原子序数小于C,B有2个电子层,最外层电子数为4,故B为C元素,C为Na;元素D的合金是日常生活中常用的金属材料,则D为Al;其中元素A、E的单质在常温下呈气态,A的原子序数小于碳元素,A为H元素,E的原子序数大于铝元素,E为Cl元素.
A.由C、H元素组成的化合物为烃类物质,有气态、液态、固态,比如苯在常温下呈液态,故A正确;
B.元素C、D的最高价氧化物对应的水化物分别为NaOH和Al(OH)3,二者反应生成偏铝酸钠与水,故B错误;
C.化合物AE为HCl,为分子晶体,只有共价键,化合物CE为NaCl,是离子晶体,存在离子键,故C错误;
D.AlCl3属于共价化合物,熔融状态下不导电,工业上通常电解熔融氧化铝冶炼铝单质,故D错误.
故选A.
点评 本题考查结构性质位置关系应用,推断元素是解题关键,难度不大,注意对基础知识的理解掌握.

练习册系列答案
 能力评价系列答案
能力评价系列答案 唐印文化课时测评系列答案
唐印文化课时测评系列答案 导学与测试系列答案
导学与测试系列答案
相关题目
6.用NA表示阿伏加德罗常数,下列说法正确的是( )
| A. | 常温常压下22.4LNH3中含有的分子总数小于NA | |
| B. | 1molFe3+完全水解生成氢氧化铁胶体粒子的数目为NA | |
| C. | 1molCl2与足量NaOH溶液反应,转移的电子数为2NA | |
| D. | 0.1 mol/L的醋酸钠溶液中含CH3COOH、CH3COO- 粒子总数为0.1 NA |
7.常温下,在由水电离出的c(H+)=1.0×10-13 mol/L溶液中一定可以大量共存的离子组是( )
| A. | Na+、NH4+、Cl-、CO32- | B. | K+、Na+、Cl-、NO3- | ||
| C. | K+、Na+、NO3-、I- | D. | Al3+、Na+、HCO3-、NO3- |
11.下列对氢氧化铁胶体性质的叙述不正确的是( )
| A. | 能产生电泳现象 | B. | 能产生丁达尔现象 | ||
| C. | 不能通过滤纸 | D. | 氢氧化铁胶体粒子带正电荷 |
1.实验室中需要配制2mol/L的NaCl溶液950mL,配制时应选用的容量瓶的规格和称取的NaCl的质量分别是
( )
( )
| A. | 950 mL 111.2 g | B. | 500 mL 117.0 g | ||
| C. | 1000 mL 117.0 g | D. | 1000 mL 111.2 g |
8.某地污水中含有Zn2+、Hg2+、Fe3+和Cu2+4种阳离子.甲、乙、丙3位同学设计的从该污水中回收金属铜的方案如下.
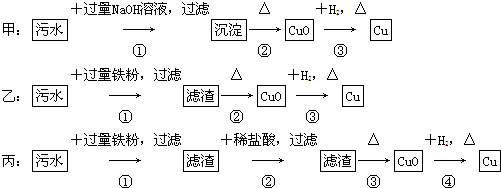
下列判断正确的是( )

下列判断正确的是( )
| A. | 三种实验方案中都能制得纯净的铜 | |
| B. | 乙方案中加过量铁粉可以将4种阳离子全部还原 | |
| C. | 甲方案中的反应涉及置换、分解、化合、复分解4种反应类型 | |
| D. | 丙方案会产生环境污染 |
6.某烃的分子式为C10H14,不能使溴水褪色,但可使酸性KMnO4溶液褪色,分子结构中只含一个烷基,则此烃的结构有( )
| A. | 3种 | B. | 4种 | C. | 5种 | D. | 6种 |