1.根据元素性质周期表递变规律,下列判断均正确的是( )
| A. | 酸性:HClO4>HBrO4>HIO4 碱性:NaOH>KOH>RbOH | |
| B. | 原子半径:Na>O>F 离子半径:Na+>O2->F- | |
| C. | 稳定性:HF>H2O>H2S 还原性:HCl<H2S<PH3 | |
| D. | 还原性:Na>Mg>Al 氧化性:P>S>Cl2 |
20.孔雀石主要含Cu2(OH)2CO3,还含少量Fe、Si的化合物.某工厂以孔雀石为主要原料制备 CuSO4•5H2O及纳米材料G,主要步骤如图1:
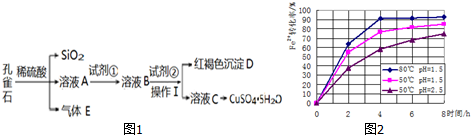
已知该条件下,通过调节溶液的酸碱性而使Fe3+、Fe2+、Cu2+生成沉淀的pH 分别如下:
请回答下列问题:
(1)在相同温度时溶度积的相对大小:Ksp[Fe(OH)2]>(填“>”或“<”)Ksp[Cu(OH)2].
(2)溶液A中的金属离子有Cu2+、Fe2+、Fe3+.试剂①是一种氧化剂,目的是氧化Fe2+(填离子符号).该工厂选用试剂①最好为下列中的b(填代号).
a.Na2O2 b.H2O2 c.Cl2d.KSCN
(3)根据如图2有关数据,你认为工业上氧化操作时应采取的措施是溶液温度控制在80℃,pH控制在1.5,氧化时间为4小时左右.
(4)向溶液B中加入试剂②的化学式为CuO,操作Ⅰ的名称是过滤.
(5)欲测定溶液A中Fe2+的浓度,可用KMnO4标准溶液滴定,反应中MnO4-被还原为Mn2+,则该反应的离子方程式为MnO4-+5Fe2++8H+=Mn2++5Fe3++4H2O.取A溶液20.00mL,用去0.0240mol/L KMnO4溶液16.00mL时恰好达到滴定终点,则A溶液中Fe2+浓度为0.096mol/L.

已知该条件下,通过调节溶液的酸碱性而使Fe3+、Fe2+、Cu2+生成沉淀的pH 分别如下:
| 物质 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 |
| 开始沉淀时的pH | 2.2 | 7.6 | 4.7 |
| 完全沉淀时的pH | 3.2 | 9.6 | 6.4 |
(1)在相同温度时溶度积的相对大小:Ksp[Fe(OH)2]>(填“>”或“<”)Ksp[Cu(OH)2].
(2)溶液A中的金属离子有Cu2+、Fe2+、Fe3+.试剂①是一种氧化剂,目的是氧化Fe2+(填离子符号).该工厂选用试剂①最好为下列中的b(填代号).
a.Na2O2 b.H2O2 c.Cl2d.KSCN
(3)根据如图2有关数据,你认为工业上氧化操作时应采取的措施是溶液温度控制在80℃,pH控制在1.5,氧化时间为4小时左右.
(4)向溶液B中加入试剂②的化学式为CuO,操作Ⅰ的名称是过滤.
(5)欲测定溶液A中Fe2+的浓度,可用KMnO4标准溶液滴定,反应中MnO4-被还原为Mn2+,则该反应的离子方程式为MnO4-+5Fe2++8H+=Mn2++5Fe3++4H2O.取A溶液20.00mL,用去0.0240mol/L KMnO4溶液16.00mL时恰好达到滴定终点,则A溶液中Fe2+浓度为0.096mol/L.
19.CoCl2•xH2O在加热时会逐步失水,并呈现不同的颜色,实验室里可以制成变色硅胶,用以干燥并验证水份.以含钴废料(含少量Fe、Al等杂质)制取CoCl2•6H2O的一种新工艺流程如图:
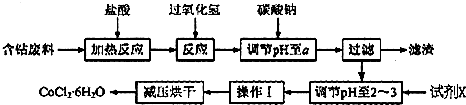
已知:
①钴与盐酸反应的化学方程式为:Co+2HCl═CoCl2+H2↑
②CoCl2•6H2O熔点86℃,易溶于水、乙醚等;常温下稳定无毒,加热至110~120℃时,失去结晶水变成有毒的无水氯化钴.
③部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
请回答下列问题:
(1)写出加入过氧化氢时溶液中发生的离子反应方程式:2Fe2++H2O2+2H+=2Fe3++2H2O
(2)加入碳酸钠调节pH至a,a的范围是5.2~7.6;
(3)最合适的试剂X是盐酸
(4)操作I包含3个基本实验操作,它们是蒸发浓缩、冷却结晶和减压过滤.
(5)制得的CoCl2•6H2O需减压烘干的原因是降低烘干温度,防止产品分解.

已知:
①钴与盐酸反应的化学方程式为:Co+2HCl═CoCl2+H2↑
②CoCl2•6H2O熔点86℃,易溶于水、乙醚等;常温下稳定无毒,加热至110~120℃时,失去结晶水变成有毒的无水氯化钴.
③部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
| 沉淀物 | Fe(OH)3 | Co(OH)3 | Al(OH)3 |
| 开始沉淀 | 2.3 | 7.6 | 3.4 |
| 完全沉淀 | 4.1 | 9.2 | 5.2 |
(1)写出加入过氧化氢时溶液中发生的离子反应方程式:2Fe2++H2O2+2H+=2Fe3++2H2O
(2)加入碳酸钠调节pH至a,a的范围是5.2~7.6;
(3)最合适的试剂X是盐酸
(4)操作I包含3个基本实验操作,它们是蒸发浓缩、冷却结晶和减压过滤.
(5)制得的CoCl2•6H2O需减压烘干的原因是降低烘干温度,防止产品分解.
17.下列各物质中,完全燃烧时生成的二氧化碳与水的物质的量之比为2:1的是( )
| A. | 乙烷 | B. | 乙烯 | C. | 苯 | D. | 乙醇 |
15.通过观察化学实验现象,分析归纳出正确的结论,是学习化学科学最基本的技能之一.下列由实验现象得出正确结论的是( )
| 选项 | 实验现象 | 结论 |
| A | 把相同大小的一块铝和镁分别投入相同浓度的NaOH溶液中:铝溶解有气泡放出,而镁没有任何变化 | 由此得出:铝的金属性比镁强 |
| B | 取一块铝箔,用酒精灯点燃:铝箔只熔化成液体而没有脱落 | 由此得出:铝不易燃烧 |
| C | 向氯化铵溶液中投入一铝片:铝片上产生大量气泡 | 由此得出:该气体是氨气 |
| D | 向氯化铝溶液中逐滴滴加NaOH溶液至过量:先产生白色沉淀,后沉淀逐渐溶解,最后沉淀完全消失 | 由此得出:氢氧化铝能溶于强碱溶液 |
| A. | A | B. | B | C. | C | D. | D |
14.不能正确表示下列反应的离子方程式是( )
0 170591 170599 170605 170609 170615 170617 170621 170627 170629 170635 170641 170645 170647 170651 170657 170659 170665 170669 170671 170675 170677 170681 170683 170685 170686 170687 170689 170690 170691 170693 170695 170699 170701 170705 170707 170711 170717 170719 170725 170729 170731 170735 170741 170747 170749 170755 170759 170761 170767 170771 170777 170785 203614
| A. | Na与稀硫酸反应的离子方程式为2Na+2H+═2Na++H2↑ | |
| B. | Na2O2溶于水产生O2:Na2O2+H2O═2Na++2OH-+O2↑ | |
| C. | 碳酸氢钙溶液中滴加氢氧化钠溶液至Ca2+恰好完全沉淀 Ca2++HCO3-+OHˉ═CaCO3↓+H2O | |
| D. | 饱和碳酸钠溶液中通入过量二氧化碳气体 CO32-+CO2+H2O═HCO3- |
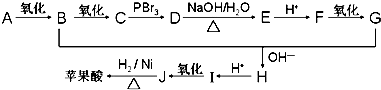
 .
.
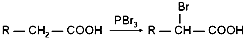
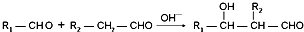
 +n HO-CH2CH2-OH$\stackrel{一定条件}{→}$
+n HO-CH2CH2-OH$\stackrel{一定条件}{→}$ +(2n-1)H2O
+(2n-1)H2O 、
、 .
.