题目内容
15.通过观察化学实验现象,分析归纳出正确的结论,是学习化学科学最基本的技能之一.下列由实验现象得出正确结论的是( )| 选项 | 实验现象 | 结论 |
| A | 把相同大小的一块铝和镁分别投入相同浓度的NaOH溶液中:铝溶解有气泡放出,而镁没有任何变化 | 由此得出:铝的金属性比镁强 |
| B | 取一块铝箔,用酒精灯点燃:铝箔只熔化成液体而没有脱落 | 由此得出:铝不易燃烧 |
| C | 向氯化铵溶液中投入一铝片:铝片上产生大量气泡 | 由此得出:该气体是氨气 |
| D | 向氯化铝溶液中逐滴滴加NaOH溶液至过量:先产生白色沉淀,后沉淀逐渐溶解,最后沉淀完全消失 | 由此得出:氢氧化铝能溶于强碱溶液 |
| A. | A | B. | B | C. | C | D. | D |
分析 A、金属性的强弱是金属与酸反应失电子的能力强弱;
B、是因为氧化铝的熔点高,而没有脱落;
C、铝与氯化铵溶液反应,是铝与铵根离子水解产生的氢离子反应生成氢气;
D、氯化铝和氢氧化钠溶液反应先生成氢氧化铝白色沉淀,反应的离子方程式为:3OH-+Al3+=Al(OH)3↓,氢氧化铝和氢氧化钠溶液生成可溶性的偏铝酸钠,反应的离子方程式为:Al(OH)3+OH-=AlO2-+2H2O.
解答 解:A、金属性的强弱是金属与酸反应失电子的能力强弱,而不是与碱反应,所以不能说明铝的金属性比镁强,故A错误;
B、是因为氧化铝的熔点高,而没有脱落,而不是铝不易燃烧,故B错误;
C、铝与氯化铵溶液反应,是铝与铵根离子水解产生的氢离子反应生成氢气,所以气体不是氨气,而是氢气,故C错误;
D、氯化铝和氢氧化钠溶液反应先生成氢氧化铝白色沉淀,反应的离子方程式为:3OH-+Al3+=Al(OH)3↓,氢氧化铝和氢氧化钠溶液生成可溶性的偏铝酸钠,反应的离子方程式为:Al(OH)3+OH-=AlO2-+2H2O,所以氢氧化铝能溶于强碱氢氧化钠溶液,故D正确;
故选D.
点评 本题考查物质的性质及检验,题目难度不大,本题注意把握常见元素化合物的性质,学生要对铝及化合物的性质充分掌握.

练习册系列答案
 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案
相关题目
20.常温常压下,某气体RO2对氢气的相对密度为32,则R的摩尔质量是( )
| A. | 32g/mol | B. | 32 | C. | 64 | D. | 64g/mol |
6.用NA表示阿伏加德罗常数,下列说法正确的是( )
| A. | 常温常压下22.4LNH3中含有的分子总数小于NA | |
| B. | 1molFe3+完全水解生成氢氧化铁胶体粒子的数目为NA | |
| C. | 1molCl2与足量NaOH溶液反应,转移的电子数为2NA | |
| D. | 0.1 mol/L的醋酸钠溶液中含CH3COOH、CH3COO- 粒子总数为0.1 NA |
3.卤族元素随核电荷数的增加,下列叙述正确的是( )
| A. | 单质的颜色逐渐加深 | B. | 气态氢化物的稳定性逐渐增强 | ||
| C. | 单质的熔点逐渐升高 | D. | 单质的氧化性逐渐增强 |
10.下列叙述正确的是( )
| A. | 构成分子晶体的粒子中一定含有共价键 | |
| B. | 在离子晶体中不可能存在非极性键 | |
| C. | 离子化合物中可能含有共价键 | |
| D. | 在原子晶体中不可能存在极性共价键 |
20.孔雀石主要含Cu2(OH)2CO3,还含少量Fe、Si的化合物.某工厂以孔雀石为主要原料制备 CuSO4•5H2O及纳米材料G,主要步骤如图1:
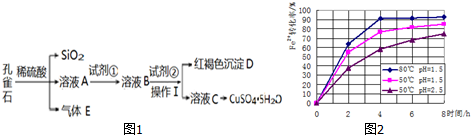
已知该条件下,通过调节溶液的酸碱性而使Fe3+、Fe2+、Cu2+生成沉淀的pH 分别如下:
请回答下列问题:
(1)在相同温度时溶度积的相对大小:Ksp[Fe(OH)2]>(填“>”或“<”)Ksp[Cu(OH)2].
(2)溶液A中的金属离子有Cu2+、Fe2+、Fe3+.试剂①是一种氧化剂,目的是氧化Fe2+(填离子符号).该工厂选用试剂①最好为下列中的b(填代号).
a.Na2O2 b.H2O2 c.Cl2d.KSCN
(3)根据如图2有关数据,你认为工业上氧化操作时应采取的措施是溶液温度控制在80℃,pH控制在1.5,氧化时间为4小时左右.
(4)向溶液B中加入试剂②的化学式为CuO,操作Ⅰ的名称是过滤.
(5)欲测定溶液A中Fe2+的浓度,可用KMnO4标准溶液滴定,反应中MnO4-被还原为Mn2+,则该反应的离子方程式为MnO4-+5Fe2++8H+=Mn2++5Fe3++4H2O.取A溶液20.00mL,用去0.0240mol/L KMnO4溶液16.00mL时恰好达到滴定终点,则A溶液中Fe2+浓度为0.096mol/L.

已知该条件下,通过调节溶液的酸碱性而使Fe3+、Fe2+、Cu2+生成沉淀的pH 分别如下:
| 物质 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 |
| 开始沉淀时的pH | 2.2 | 7.6 | 4.7 |
| 完全沉淀时的pH | 3.2 | 9.6 | 6.4 |
(1)在相同温度时溶度积的相对大小:Ksp[Fe(OH)2]>(填“>”或“<”)Ksp[Cu(OH)2].
(2)溶液A中的金属离子有Cu2+、Fe2+、Fe3+.试剂①是一种氧化剂,目的是氧化Fe2+(填离子符号).该工厂选用试剂①最好为下列中的b(填代号).
a.Na2O2 b.H2O2 c.Cl2d.KSCN
(3)根据如图2有关数据,你认为工业上氧化操作时应采取的措施是溶液温度控制在80℃,pH控制在1.5,氧化时间为4小时左右.
(4)向溶液B中加入试剂②的化学式为CuO,操作Ⅰ的名称是过滤.
(5)欲测定溶液A中Fe2+的浓度,可用KMnO4标准溶液滴定,反应中MnO4-被还原为Mn2+,则该反应的离子方程式为MnO4-+5Fe2++8H+=Mn2++5Fe3++4H2O.取A溶液20.00mL,用去0.0240mol/L KMnO4溶液16.00mL时恰好达到滴定终点,则A溶液中Fe2+浓度为0.096mol/L.
7.常温下,在由水电离出的c(H+)=1.0×10-13 mol/L溶液中一定可以大量共存的离子组是( )
| A. | Na+、NH4+、Cl-、CO32- | B. | K+、Na+、Cl-、NO3- | ||
| C. | K+、Na+、NO3-、I- | D. | Al3+、Na+、HCO3-、NO3- |