题目内容
20.孔雀石主要含Cu2(OH)2CO3,还含少量Fe、Si的化合物.某工厂以孔雀石为主要原料制备 CuSO4•5H2O及纳米材料G,主要步骤如图1: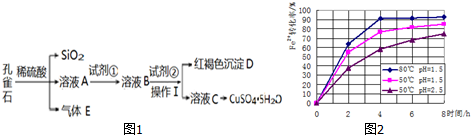
已知该条件下,通过调节溶液的酸碱性而使Fe3+、Fe2+、Cu2+生成沉淀的pH 分别如下:
| 物质 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 |
| 开始沉淀时的pH | 2.2 | 7.6 | 4.7 |
| 完全沉淀时的pH | 3.2 | 9.6 | 6.4 |
(1)在相同温度时溶度积的相对大小:Ksp[Fe(OH)2]>(填“>”或“<”)Ksp[Cu(OH)2].
(2)溶液A中的金属离子有Cu2+、Fe2+、Fe3+.试剂①是一种氧化剂,目的是氧化Fe2+(填离子符号).该工厂选用试剂①最好为下列中的b(填代号).
a.Na2O2 b.H2O2 c.Cl2d.KSCN
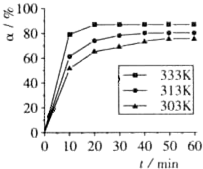
(3)根据如图2有关数据,你认为工业上氧化操作时应采取的措施是溶液温度控制在80℃,pH控制在1.5,氧化时间为4小时左右.
(4)向溶液B中加入试剂②的化学式为CuO,操作Ⅰ的名称是过滤.
(5)欲测定溶液A中Fe2+的浓度,可用KMnO4标准溶液滴定,反应中MnO4-被还原为Mn2+,则该反应的离子方程式为MnO4-+5Fe2++8H+=Mn2++5Fe3++4H2O.取A溶液20.00mL,用去0.0240mol/L KMnO4溶液16.00mL时恰好达到滴定终点,则A溶液中Fe2+浓度为0.096mol/L.
分析 向孔雀石中加入足量稀硫酸,发生的反应有Cu2(OH)2CO3+4HCl=2CuCl2+3H2O+CO2↑,溶液A只含Cu2+、Fe2+、Fe3+三种金属离子,铁的氧化物溶于稀硫酸生成铁盐、亚铁盐和水,然后过滤得到的滤渣中含有Si的氧化物,溶液A中含有含有铁盐和亚铁盐及硫酸铜,气体E为CO2,向溶液A中加入试剂①得到溶液B,试剂①是一种氧化剂,将Fe2+转化为Fe3+且不能引进杂质,应该选取双氧水,向溶液B中加入试剂②经过操作Ⅰ得到溶液C和红褐色沉淀D,则操作Ⅰ为过滤,D为Fe(OH)3,溶液C为硫酸铜溶液,所以为试剂②为CuO,据此答题.
解答 解:向孔雀石中加入足量稀硫酸,发生的反应有Cu2(OH)2CO3+4HCl=2CuCl2+3H2O+CO2↑,溶液A只含Cu2+、Fe2+、Fe3+三种金属离子,铁的氧化物溶于稀硫酸生成铁盐、亚铁盐和水,然后过滤得到的滤渣中含有Si的氧化物,溶液A中含有含有铁盐和亚铁盐及硫酸铜,气体E为CO2,向溶液A中加入试剂①得到溶液B,试剂①是一种氧化剂,将Fe2+转化为Fe3+且不能引进杂质,应该选取双氧水,向溶液B中加入试剂②经过操作Ⅰ得到溶液C和红褐色沉淀D,则操作Ⅰ为过滤,D为Fe(OH)3,溶液C为硫酸铜溶液,所以为试剂②为CuO,
(1)根据题中信息可知,Cu(OH)2在pH=4.7时开始沉淀,而Fe(OH)2在pH=7.6时开始沉淀,所以在相同温度时溶度积的相对大小:Ksp[Fe(OH)2]>Ksp[Cu(OH)2],
故答案为:>;
(2)“试剂1”的目的是将溶液中的Fe2+转化为Fe3+,且不能引进杂质,加入双氧水,双氧水是一种绿色试剂,将Fe2+氧化为Fe3+,不会引入杂质,故选b,
故答案为:Fe2+;b;
(3)根据如图2有关数据可知,pH值相等时温度越高Fe2+转化率越高,温度相等时pH值越小Fe2+转化率越高,所以工业上氧化操作时应采取的措施是溶液温度控制在80℃,pH控制在1.5,氧化时间为4小时左右Fe2+转化率达到较大值,4小时以后变化不大,
故答案为:80;1.5;4;
(4)根据上面的分析可知,试剂②为CuO,操作Ⅰ为过滤,
故答案为:CuO;过滤;
(5)Fe2+溶液与KMnO4溶液发生氧化还原反应,反应中MnO4-被还原为Mn2+,反应的离子方程式为MnO4-+5Fe2++8H+=Mn2++5Fe3++4H2O,根据离子方程可知MnO4-~5Fe2+,用去 KMnO4的物质的量为16.00mL×0.0240mol/L=3.84×10-4mol,所以A溶液中Fe2+浓度为$\frac{3.84×10{\;}^{-4}mol×5}{0.02L}$=0.096mol/L,
故答案为:MnO4-+5Fe2++8H+=Mn2++5Fe3++4H2O;0.096mol/L.
点评 本题考查物质制备及物质分离和提纯,为高考高频点,侧重考查学生分析、计算及实验操作能力,关键是明确实验原理及基本操作方法,知道流程图中发生的反应及操作方法,难点是(5)的计算,要进行微粒之间的转换,题目难度中等.

 王后雄学案教材完全解读系列答案
王后雄学案教材完全解读系列答案| A. | Zn与稀H2SO4反应:Zn+H+═Zn2++H2↑ | |
| B. | Na2CO3溶液与足量盐酸反应:CO32-+2H+═H2O+CO2↑ | |
| C. | Cl2与NaOH溶液反应:Cl2+2OH-═2Cl-+H2O | |
| D. | MgCl2溶液与过量氨水反应:Mg2++2OH-═Mg(OH)2↓ |
| 选项 | 实验现象 | 结论 |
| A | 把相同大小的一块铝和镁分别投入相同浓度的NaOH溶液中:铝溶解有气泡放出,而镁没有任何变化 | 由此得出:铝的金属性比镁强 |
| B | 取一块铝箔,用酒精灯点燃:铝箔只熔化成液体而没有脱落 | 由此得出:铝不易燃烧 |
| C | 向氯化铵溶液中投入一铝片:铝片上产生大量气泡 | 由此得出:该气体是氨气 |
| D | 向氯化铝溶液中逐滴滴加NaOH溶液至过量:先产生白色沉淀,后沉淀逐渐溶解,最后沉淀完全消失 | 由此得出:氢氧化铝能溶于强碱溶液 |
| A. | A | B. | B | C. | C | D. | D |
| A. | 1-丁烯和环己烷 | B. | 1-庚烯和3-甲基-1-丁烯 | ||
| C. | 1-氯丙烷和2-氯丙烷 | D. | 甲苯和乙苯 |
H3BO3的转化率(α)在不同温度下随反应时间(t)的变化如右图,由此图可以得出:该反应的△H( )
| A. | △H<0 | B. | △H>0 | C. | △H=0 | D. | 无法判断 |
①SiO2+2C$\frac{\underline{\;高温\;}}{\;}$Si(粗)+2CO↑
②Si(粗)+2Cl2$\frac{\underline{\;加热\;}}{\;}$SiCl4
③SiCl4+2H2$\frac{\underline{\;高温\;}}{\;}$Si(纯)+4HCl
关于上述反应的分析不正确的是( )
| A. | ①、③是置换反应,②是化合反应 | |
| B. | 高温下,焦炭与氢气的还原性均弱于硅 | |
| C. | 任一反应中,每消耗或生成28 g硅,均转移4 mol电子 | |
| D. | 在第三个反应中,SiCl4作氧化剂 |
 置换反应的通式可表示为如图所示:请回答下列问题:
置换反应的通式可表示为如图所示:请回答下列问题: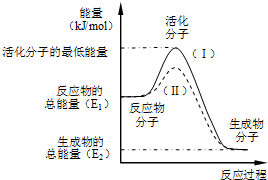 在化学反应中,只有极少数能量比平均能量高得多的反应物分子发生碰撞时才可能发生化学反应,这些分子称为活化分子,使普通分子变成活化分子所需提供的最低限度的能量叫活化能,其单位通常用kJ/mol表示.请认真观察如图,然后回答问题.
在化学反应中,只有极少数能量比平均能量高得多的反应物分子发生碰撞时才可能发生化学反应,这些分子称为活化分子,使普通分子变成活化分子所需提供的最低限度的能量叫活化能,其单位通常用kJ/mol表示.请认真观察如图,然后回答问题.