7.把500mL含有BaCl2和KCl的混合溶液分成5等份,取一份加入含a mol硫酸钠的溶液,恰好使钡离子完全沉淀;另取一份加入含b mol硝酸银的溶液,恰好使氯离子完全沉淀.则该混合溶液中钾离子浓度为( )
| A. | 0.1(b-2a)mol•L-1 | B. | 10(2a-b)mol•L-1 | C. | 10(b-a)mol•L-1 | D. | 10(b-2a)mol•L-1 |
6.已知氨水的浓度越大,密度越小.将质量分数为W%的氨水和质量分数为5W%的氨水等体积混合,所得溶液中氨的质量分数为( )
| A. | 6W% | B. | 3W% | C. | 大于3W% | D. | 小于3W% |
5.下列对于“摩尔”的理解正确的是( )
| A. | 摩尔是国际单位制的一个基本物理量 | |
| B. | 摩尔是物质的量的单位,简称摩,符号为mol | |
| C. | 摩尔可以把物质的宏观数量与微观粒子的数量联系起来 | |
| D. | 表示6.02×1023个粒子的集合体 |
4.实验室用密度为1.25g•L-1溶质质量分数为36.5%的浓盐酸配制240mL0.1mol•L-1的盐酸,请问答下列问题:
(1)浓盐酸的物质的量浓度为12.5mol.l-1.
(2)配制240mL 0.1mol•L-1的盐酸
(3)配制时,正确的操作顺序是BCAFED(用字母表示,位个字母只能用一次,并将步骤A,E补充完整)
A.用30mL水洗涤烧杯和玻璃杯2-3次,洗涤液均注人容量瓶,振荡
B.用量筒准确量取所需的浓盐酸的体积,沿玻璃棒倒入烧杯中,再加人少量水(约30mL),用玻璃棒慢慢搅动,使其混合均匀
C.将已冷却的盐酸沿玻璃棒注人容量瓶中
D.将容最瓶盖紧,振荡、摇匀
E.改用胶头滴管加水,使溶液凹液面最低处恰好与刻度线相切
F.继续往容量瓶内小心加水,直到液面距离刻度线1-2cm处
(4)操作A中,将洗涤液都移人容量瓶,其目的是保证溶质全部转移到容量瓶.
(1)浓盐酸的物质的量浓度为12.5mol.l-1.
(2)配制240mL 0.1mol•L-1的盐酸
| 应量取浓盐酸体积/mL | 应选用容量瓶的规格/mL |
A.用30mL水洗涤烧杯和玻璃杯2-3次,洗涤液均注人容量瓶,振荡
B.用量筒准确量取所需的浓盐酸的体积,沿玻璃棒倒入烧杯中,再加人少量水(约30mL),用玻璃棒慢慢搅动,使其混合均匀
C.将已冷却的盐酸沿玻璃棒注人容量瓶中
D.将容最瓶盖紧,振荡、摇匀
E.改用胶头滴管加水,使溶液凹液面最低处恰好与刻度线相切
F.继续往容量瓶内小心加水,直到液面距离刻度线1-2cm处
(4)操作A中,将洗涤液都移人容量瓶,其目的是保证溶质全部转移到容量瓶.
3.氧化还原反应与四种基本反应类型的关系如图所示.下列化学反应属于阴影部分的是( )


| A. | Cl2+2NaBr═2NaCl+Br2 | B. | 4Fe(OH)2+O2+2H2O═4Fe(OH)3 | ||
| C. | 2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2O+CO2↑ | D. | 4NH3+5O2$\frac{\underline{\;\;△\;\;}}{\;}$4NO+6H2O |
2.对于H2在O2中燃烧反应的描述,正确的是( )
| A. | 该反应属于放热反应 | B. | 断开H-H键放出能量 | ||
| C. | 形成O-H键吸收能量 | D. | 反应后生成物总能量升高 |
1.下列各组离子在溶液中可以大量共存的是( )
0 170509 170517 170523 170527 170533 170535 170539 170545 170547 170553 170559 170563 170565 170569 170575 170577 170583 170587 170589 170593 170595 170599 170601 170603 170604 170605 170607 170608 170609 170611 170613 170617 170619 170623 170625 170629 170635 170637 170643 170647 170649 170653 170659 170665 170667 170673 170677 170679 170685 170689 170695 170703 203614
| A. | Ba2+、NO3-、OH-、K+ | B. | H+、K+、CO32-、SO42- | ||
| C. | Mg2+、NH4+、OH-、Cl- | D. | Ba+、Na+、Cl-、SO42- |
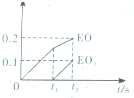 将E单质缓慢通入石灰水中,若生成物中有三种含E元素的离子,其中两种离子的物质的量与反应时间的曲线如图所示,则t1时刻[n(EO-)=0.15mol]消耗氢氧化钙的物质的量为0.15mol,t2时总反应的化学方程式为10Cl2+10Ca(OH)2=7CaCl2+2Ca(ClO)2+Ca(ClO3)2+10H2O.
将E单质缓慢通入石灰水中,若生成物中有三种含E元素的离子,其中两种离子的物质的量与反应时间的曲线如图所示,则t1时刻[n(EO-)=0.15mol]消耗氢氧化钙的物质的量为0.15mol,t2时总反应的化学方程式为10Cl2+10Ca(OH)2=7CaCl2+2Ca(ClO)2+Ca(ClO3)2+10H2O.