18.常温下,最适宜薄荷生长的土壤pH≈8,土壤中的c(OH-)最接近于( )
| A. | 1×10-5mol/L | B. | 1×10-6mol/L | C. | 1×10-8mol/L | D. | 1×10-9molL |
17.下列反应中,属于吸热反应的是( )
| A. | Al与盐酸反应 | B. | 盐酸和NaOH溶液反应 | ||
| C. | 乙醇燃烧反应 | D. | Ba(OH)2•8H2O晶体与NH4Cl固体反应 |
16.下列能源的大量使用会导致全球进一步变暖、雾霾天气增多的是( )
| A. | 化石能源 | B. | 太阳能 | C. | 氢能 | D. | 地热能 |
14.运用化学反应原理知识回答下列有关碳和碳的化合物的问题:
(1)汽车尾气的主要污染物是NO以及燃料燃烧不完全所产生的CO,它们是现代化城市的重要大气污染物,为了减轻汽车尾气造成的大气污染,人们开始探索利用NO和CO在一定条件下转化为两种无毒气体E和F的方法(已知该反应的△H<0). 在2L密闭容器中加入一定量NO和CO,当温度分别在T1和T2时,测得各物质平衡时物质的量如下表:
①请结合上表数据,写出NO与CO反应的化学方程式2CO+2NO═N2+2CO2.
②上述反应T1℃时的平衡常数为K1,T2℃时的平衡常数为K2,根据表中数据计算K1=3200L/mol(或3200).根据表中数据判断,温度T1和T2的关系是(填序号)A.
A.T1>T2B.T1<T2 C.T1=T2 D.无法比较
(2)反应生成的气体E经常用氢氧化钠溶液来吸收,现有0.4molE,若用200mL 3mol/L NaOH溶液将其完全吸收,则溶液中离子浓度由大到小的顺序为:c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+).
(3)常温下,向(2)所得的混合溶液中,滴加盐酸至中性时,溶质的主要成分有NaCl、NaHCO3、H2CO3或CO2.
(4)已知CH4、H2和CO的燃烧热分别为890.3kJ/mol、285.8kJ/mol和283.0kJ/mol,工业上利用天然气(主要成分是CH4)与CO2进行高温重整制备CO和H2,写出该反应的热化学方程式:CH4(g)+CO2(g)═2CO(g)+H2(g)△H=+247.3kJ•mol-1.
(5)CO还可以用做燃料电池的燃料,某熔融盐燃料电池具有较高的发电效率,因而受到特别重视,该电池用 Li2CO3 和 Na2CO3 的熔融盐混合物作电解质,CO为负极燃气,空气与CO2 的混合气为正极助燃气,制得在 650℃下工作的燃料电池,请写出其负极的电极式:2CO-4e-+2CO32-=4CO2.
(1)汽车尾气的主要污染物是NO以及燃料燃烧不完全所产生的CO,它们是现代化城市的重要大气污染物,为了减轻汽车尾气造成的大气污染,人们开始探索利用NO和CO在一定条件下转化为两种无毒气体E和F的方法(已知该反应的△H<0). 在2L密闭容器中加入一定量NO和CO,当温度分别在T1和T2时,测得各物质平衡时物质的量如下表:
物质 T/℃n/mol | NO | CO | E | F |
| 初始 | 0.100 | 0.100 | 0 | 0 |
| T1 | 0.020 | 0.020 | 0.080 | 0.040 |
| T2 | 0.010 | 0.010 | 0.090 | 0.045 |
②上述反应T1℃时的平衡常数为K1,T2℃时的平衡常数为K2,根据表中数据计算K1=3200L/mol(或3200).根据表中数据判断,温度T1和T2的关系是(填序号)A.
A.T1>T2B.T1<T2 C.T1=T2 D.无法比较
(2)反应生成的气体E经常用氢氧化钠溶液来吸收,现有0.4molE,若用200mL 3mol/L NaOH溶液将其完全吸收,则溶液中离子浓度由大到小的顺序为:c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+).
(3)常温下,向(2)所得的混合溶液中,滴加盐酸至中性时,溶质的主要成分有NaCl、NaHCO3、H2CO3或CO2.
(4)已知CH4、H2和CO的燃烧热分别为890.3kJ/mol、285.8kJ/mol和283.0kJ/mol,工业上利用天然气(主要成分是CH4)与CO2进行高温重整制备CO和H2,写出该反应的热化学方程式:CH4(g)+CO2(g)═2CO(g)+H2(g)△H=+247.3kJ•mol-1.
(5)CO还可以用做燃料电池的燃料,某熔融盐燃料电池具有较高的发电效率,因而受到特别重视,该电池用 Li2CO3 和 Na2CO3 的熔融盐混合物作电解质,CO为负极燃气,空气与CO2 的混合气为正极助燃气,制得在 650℃下工作的燃料电池,请写出其负极的电极式:2CO-4e-+2CO32-=4CO2.
13.Ⅰ.(1)在课本甲烷和氯气的取代反应实验中,向大试管中充入反应气体的方法是通过排饱和食盐水的方法先后收集半试管甲烷和半试管氯气.
(2)CO2在自然界循环时可与CaCO3反应,CaCO3是一种难溶物质,其Ksp=3.8×10 -9.CaCl2溶液与Na2CO3溶液混合可形成CaCO3沉淀,现将等体积的CaCl2溶液与Na2CO3溶液混合,若Na2CO3溶液的浓度为4×10 -4mo1/L,则生成沉淀所需CaCl2溶液的最小浓度为3.8×10-5mol/L.
Ⅱ.在温度t℃下,某Ba(OH)2的稀溶液中c(H+)=10-amol/L,c(OH-)=10-bmol/L,已知a+b=12,向该溶液中逐滴加入pH=b的NaHSO4,测得混合溶液的部分pH如下表所示:
(1)x=27.00ml.
(2)将此温度下的Ba(OH)2溶液取出1ml,加水稀释至1L,则此稀释后的溶液中c(Ba2+)﹕c(OH-)=1:20;
(3)与NaHSO4相同,NaHSO3 和NaHCO3也为酸式盐.已知NaHSO3溶液呈酸性、NaHCO3溶液呈碱性.现有浓度均为0.1mol•L-1的NaHSO3溶液和NaHCO3溶液,溶液中各粒子的物质的量浓度存在下列关系(R表示S或C),其中可能正确的是AC(填字母)
A.c(Na+)>c(HRO3-)>c(H+)>c(RO32-)>c(OH-)
B.c(Na+)+c(H+)=c(HRO3-)+c(RO32-)+c(OH-)
C.c(H+)+c(H2RO3)=c(RO32-)+c(OH-)
D.两溶液中c(Na+)、c(HRO3-)、c(RO32-)分别相等.
(2)CO2在自然界循环时可与CaCO3反应,CaCO3是一种难溶物质,其Ksp=3.8×10 -9.CaCl2溶液与Na2CO3溶液混合可形成CaCO3沉淀,现将等体积的CaCl2溶液与Na2CO3溶液混合,若Na2CO3溶液的浓度为4×10 -4mo1/L,则生成沉淀所需CaCl2溶液的最小浓度为3.8×10-5mol/L.
Ⅱ.在温度t℃下,某Ba(OH)2的稀溶液中c(H+)=10-amol/L,c(OH-)=10-bmol/L,已知a+b=12,向该溶液中逐滴加入pH=b的NaHSO4,测得混合溶液的部分pH如下表所示:
| 序号 | 氢氧化钡溶液的体积/mL | 硫酸氢钠溶液的体积/mL | 溶液的pH |
| ① | 33.00 | 0.00 | 8 |
| ② | 33.00 | x | 7 |
| ③ | 33.00 | 33.00 | 6 |
(2)将此温度下的Ba(OH)2溶液取出1ml,加水稀释至1L,则此稀释后的溶液中c(Ba2+)﹕c(OH-)=1:20;
(3)与NaHSO4相同,NaHSO3 和NaHCO3也为酸式盐.已知NaHSO3溶液呈酸性、NaHCO3溶液呈碱性.现有浓度均为0.1mol•L-1的NaHSO3溶液和NaHCO3溶液,溶液中各粒子的物质的量浓度存在下列关系(R表示S或C),其中可能正确的是AC(填字母)
A.c(Na+)>c(HRO3-)>c(H+)>c(RO32-)>c(OH-)
B.c(Na+)+c(H+)=c(HRO3-)+c(RO32-)+c(OH-)
C.c(H+)+c(H2RO3)=c(RO32-)+c(OH-)
D.两溶液中c(Na+)、c(HRO3-)、c(RO32-)分别相等.
12.次氯酸可用于杀菌消毒.已知25°C时:[①HClO(aq)+OH-(aq)=ClO-(aq)+H2O(l)△H=-Q1kJ•mol-1②H+(aq)+OH-(aq)=H2O(l)△H=-57.3kJ•mol-1下列说法正确的是( )
| A. | 已知酸性H2SO3>HClO>HSO3-,则向Na2SO3溶液中加入HClO的离子方程式为:SO32-+HClO=HSO3-+ClO- | |
| B. | 将20ml 1mol/L HClO溶液与10ml 1mol/L NaOH溶液混合后,所得的混合溶液中一定存在:2c(H+)-2c(OH-)=c(ClO-)-c(HClO) | |
| C. | 在25°C时,次氯酸的电离方程式及热效应可表示为:HClO(aq)?H+(aq)+ClO-(aq)△H=-(57.3+Q1)kJ•mol-1 | |
| D. | 已知酸性CH3COOH>HClO,则等浓度CH3COONa和NaClO的混合液中:c(Na+)>c(ClO-)>c(CH3COO-)>c(OH-)>c(H+) |
11.下列热化学方程式或离子方程式中,正确的是( )
| A. | 向溴乙烷中滴入AgNO3溶液检验其中的溴元素:Br-+Ag+═AgBr↓ | |
| B. | 一定条件下,将0.5mol N2(g)和1.5molH2(g)置于密闭的容器中,充分反应生成NH3(g),放热19.3kJ,其热化学方程式为:N2(g)+3H2(g)?2NH3(g)△H=-38.6kJ•mol-1 | |
| C. | 0.01mol•L-1NH4Al(SO4)2溶液与0.02mol•L-1Ba(OH)2溶液等体积混合:NH4++Al3++2SO42-+2Ba2++4OH-=2BaSO4↓+Al(OH)3↓+NH3•H2O | |
| D. | CO(g)的燃烧热是283.0 kJ•mol-1,则CO2分解的热化学方程式为:2CO2(g)=2CO(g)+O2(g)△H=+283.0 kJ•mol-1 |
10.NA代表阿伏加德罗常数的数值,下列说法正确的是( )
0 170455 170463 170469 170473 170479 170481 170485 170491 170493 170499 170505 170509 170511 170515 170521 170523 170529 170533 170535 170539 170541 170545 170547 170549 170550 170551 170553 170554 170555 170557 170559 170563 170565 170569 170571 170575 170581 170583 170589 170593 170595 170599 170605 170611 170613 170619 170623 170625 170631 170635 170641 170649 203614
| A. | 1 mol Cl2参加的任何反应,反应过程中转移电子数都是2NA | |
| B. | 标准状况下,22.4mL水中含有的分子数目约为1.24NA | |
| C. | 常温常压下,17g甲基(-14CH3)所含的中子数为9NA | |
| D. | 0.1 mol Na2O2中含有的离子数为0.4 NA |
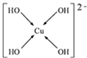 ;N3-和CO2是等电子体,则N3-的结构式为[N=N=N]-.
;N3-和CO2是等电子体,则N3-的结构式为[N=N=N]-.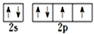 .
.