18.NA为阿伏加德罗常数,下列说法正确的是( )
| A. | 标准状况下,11.2 L三氧化硫所含有的原子数目为2NA | |
| B. | 分解H2O2制O2,每生成1mol O2转移2NA个电子 | |
| C. | 62 g Na2O溶于水后所得溶液中含有O2-数为NA | |
| D. | 36.5 g HCl中含有Cl-数为NA |
17.常温下,下列各组物质不能用一种试剂通过化学反应区别的是( )
| A. | 苯 乙酸乙酯 乙醇 | B. | AgNO3 KNO3 Na2CO3 | ||
| C. | MnO2 CuO FeO | D. | (NH4)2SO4 K2SO4 NH4Cl |
16.下列说法中,不正确的是( )
| A. | SO2(g)+0.5O2(g)?SO3(g)△H=-213kJ•mol-1 说明25℃,101kPa下,lmolSO2与0.5mol氧气放入密闭容器中生成SO3时放出213 kJ热量 | |
| B. | 若反应物总能量高于生成物总能量,反应放热,△H<0 | |
| C. | 化学反应必然伴随能量变化 | |
| D. | 酸和碱的中和反应都是放热反应 |
15.下列物质不能与二氧化硅发生化学反应的是( )
| A. | CaO | B. | 氢氟酸 | C. | NaOH溶液 | D. | 浓硫酸 |
14.铟产业被称为“信息时代的朝阳产业”.元素周期表中铟的数据如图,下列说法完全正确的是( )

| A. | 铟元素的质量数是114.8 | |
| B. | 铟元素的相对原子质量是114 | |
| C. | 铟原子最外层有3个能量相同的电子 | |
| D. | 铟元素是一种主族元素 |
12.在25℃时,某溶液中,由水电离出的c(H+)=1×10-12mol/L,则该溶液的pH可能是( )
| A. | 12 | B. | 7 | C. | 6 | D. | 2 |
11.100mL 6mol/LH2SO4跟过量锌粉反应,在一定温度下,为了减缓反应进行的速率,但又不影响生成氢气的总量,可向反应物中加入适量的( )
| A. | 碳酸钠(s) | B. | 醋酸钠(s) | C. | 硫酸钠(aq) | D. | 硫酸钾(s) |
9.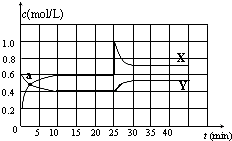 已知NO2和N2O4可以相互转化:N2O4(g)?2NO2(g)△H<0.在恒温条件下将一定量NO2和N2O4的混合气体通入一容积为2L的密闭容器中,反应物浓度随时间变化关系如图.下列说法不正确的是( )
已知NO2和N2O4可以相互转化:N2O4(g)?2NO2(g)△H<0.在恒温条件下将一定量NO2和N2O4的混合气体通入一容积为2L的密闭容器中,反应物浓度随时间变化关系如图.下列说法不正确的是( )
0 170245 170253 170259 170263 170269 170271 170275 170281 170283 170289 170295 170299 170301 170305 170311 170313 170319 170323 170325 170329 170331 170335 170337 170339 170340 170341 170343 170344 170345 170347 170349 170353 170355 170359 170361 170365 170371 170373 170379 170383 170385 170389 170395 170401 170403 170409 170413 170415 170421 170425 170431 170439 203614
 已知NO2和N2O4可以相互转化:N2O4(g)?2NO2(g)△H<0.在恒温条件下将一定量NO2和N2O4的混合气体通入一容积为2L的密闭容器中,反应物浓度随时间变化关系如图.下列说法不正确的是( )
已知NO2和N2O4可以相互转化:N2O4(g)?2NO2(g)△H<0.在恒温条件下将一定量NO2和N2O4的混合气体通入一容积为2L的密闭容器中,反应物浓度随时间变化关系如图.下列说法不正确的是( )| A. | 图中的两条曲线,X是表示NO2浓度随时间的变化曲线 | |
| B. | a点时v(N2O4)=v(NO2) | |
| C. | 25min时改变了影响速率的一个因素,使得NO2转变为N2O4,该改变是将密闭容器的体积缩小,增大压强 | |
| D. | 前10min内用v(N2O4)表示的化学反应速率为0.02 mol/(L•min) |
 单斜硫和正交硫转化为二氧化硫的能量变化图如图,回答下列问题:
单斜硫和正交硫转化为二氧化硫的能量变化图如图,回答下列问题: