10.下列金属冶炼原理对应的冶炼方法,与工业上冶炼铝相同的是( )
| A. | 2NaCl(熔融)$\frac{\underline{\;电解\;}}{\;}$2Na+Cl↑ | B. | Fe+CuSO4═FeSO4+Cu | ||
| C. | Fe203+3CO$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2 | D. | 2Ag2O$\frac{\underline{\;\;△\;\;}}{\;}$4Ag+O2↑ |
8.请结合所学知识,回答下列问题:
(1)SO2是形成酸雨的元凶,它主要来源于煤和石油的燃烧.某实验小组采集酸雨
样品,随着时间的推移,多次测定该样品pH,得到了如下数据:
①分析酸雨样品pH变化的主要原因(用化学方程式表示)2H2SO3+O2═2H2SO4;
②酸雨可导致下列哪些危害abd(填字母代号).
a.腐蚀建筑物 b.破坏农作物 c.造成洪涝灾害 d.使土壤、湖泊酸化
(2)在无机非金属材料中,硅及其化合物扮演着重要角色.
①实验室用于盛放碱性试剂的试剂瓶不用磨口玻璃塞.其原因是(用离子方程式表示)SiO2+2OH-═SiO32-+H2O;
②教材中有如下实验:取两个相同的滤纸条,分别放入蒸馏水和Na2SiO3饱和溶液中,使之充分吸湿、浸透,取出稍沥干(不再滴液)后,同时分别放置在酒精灯外焰处.观察到的现象如下表:
请据此回答设计实验a的目的是与实验b作对照,证明起防火作用的是Na2SiO3而不是水.
(3)NO是大气污染物之一,近年来发现它有扩张血管,增强记忆的功能,因此成为生命科学的研究热点.
①汽车点火启动时产生的尾气是NO污染的主要来源,该反应的化学方程为N2+O2$\frac{\underline{\;放电\;}}{\;}$2NO;
②把NO气体压缩到1.01×107Pa,并加热到一定温度,发现气体压强迅速下降.当压强降至原来的$\frac{2}{3}$时,压强不再改变.已知,其中一种气体产物为N2O,则上述变化的化学方程式为3NO=N2O+NO2.
(1)SO2是形成酸雨的元凶,它主要来源于煤和石油的燃烧.某实验小组采集酸雨
样品,随着时间的推移,多次测定该样品pH,得到了如下数据:
| 时间(h) | 开始 | 8 | 16 | 24 | 32 | 40 | 48 |
| pH | 5.0 | 4.8 | 4.5 | 4.3 | 4.2 | 4.0 | 4.0 |
②酸雨可导致下列哪些危害abd(填字母代号).
a.腐蚀建筑物 b.破坏农作物 c.造成洪涝灾害 d.使土壤、湖泊酸化
(2)在无机非金属材料中,硅及其化合物扮演着重要角色.
①实验室用于盛放碱性试剂的试剂瓶不用磨口玻璃塞.其原因是(用离子方程式表示)SiO2+2OH-═SiO32-+H2O;
②教材中有如下实验:取两个相同的滤纸条,分别放入蒸馏水和Na2SiO3饱和溶液中,使之充分吸湿、浸透,取出稍沥干(不再滴液)后,同时分别放置在酒精灯外焰处.观察到的现象如下表:
| 编号 | 实验 | 现象 |
| a | 放入蒸馏水 | 木条燃烧 |
| b | 放入Na2SiO3饱和溶液 | 木条不燃烧 |
(3)NO是大气污染物之一,近年来发现它有扩张血管,增强记忆的功能,因此成为生命科学的研究热点.
①汽车点火启动时产生的尾气是NO污染的主要来源,该反应的化学方程为N2+O2$\frac{\underline{\;放电\;}}{\;}$2NO;
②把NO气体压缩到1.01×107Pa,并加热到一定温度,发现气体压强迅速下降.当压强降至原来的$\frac{2}{3}$时,压强不再改变.已知,其中一种气体产物为N2O,则上述变化的化学方程式为3NO=N2O+NO2.
7.将一定量铜粉加入到120mL某浓度的稀硝酸中,充分反应后,容器中剩余mg铜粉,此时共收集到NO气体336mL(标准状况).然后向上述混合物中加入足量稀硫酸至不再反应为止,容器剩余铜粉n g,则加入硫酸后消耗铜粉的质量为( )
| A. | 0.96 g | B. | 2.88 g | C. | 4.32 g | D. | 5.76 g |
6.已知氨的催化氧化法制取硝酸的第一步反应:4NH3+5O2═4NO+6H2O(g),当反应中有m个电子转移时,下列说法正确的是(设NA为阿伏加德罗常数)( )
| A. | 生成水蒸气体积为6.72m/NA L | B. | 参加反应的氨气为m/5 mol | ||
| C. | 生成NO的质量为6mNA g | D. | 发生还原反应的原子数为m/2 个 |
5.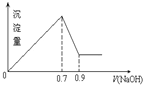 现有AlCl3和Fe2(SO4)3的混合溶液,向其中不断加入 NaOH溶液得到的沉淀的量与加入NaOH溶液的体积的关系如图所示,则原溶液中SO42-与Cl-的物质的量浓度之比为( )
现有AlCl3和Fe2(SO4)3的混合溶液,向其中不断加入 NaOH溶液得到的沉淀的量与加入NaOH溶液的体积的关系如图所示,则原溶液中SO42-与Cl-的物质的量浓度之比为( )
 现有AlCl3和Fe2(SO4)3的混合溶液,向其中不断加入 NaOH溶液得到的沉淀的量与加入NaOH溶液的体积的关系如图所示,则原溶液中SO42-与Cl-的物质的量浓度之比为( )
现有AlCl3和Fe2(SO4)3的混合溶液,向其中不断加入 NaOH溶液得到的沉淀的量与加入NaOH溶液的体积的关系如图所示,则原溶液中SO42-与Cl-的物质的量浓度之比为( )| A. | 3:1 | B. | 1:12 | C. | 3:2 | D. | 6:1 |
4.下列有关浓硫酸的叙述完全正确的一组是:( )
①浓硫酸具有强氧化性,SO2具有强还原性,所以浓硫酸不能干燥SO2气体
②浓硫酸与铜加热反应后,铜片有剩余,硫酸反应完全
③浓硫酸具有脱水性,因而能使蔗糖、纸张等炭化
④浓硫酸与铁加热反应后,铁片有剩余,生成的气体中除水蒸气外只有氢气
⑤浓硫酸在常温下能使用铁制或铝制容器盛放.
①浓硫酸具有强氧化性,SO2具有强还原性,所以浓硫酸不能干燥SO2气体
②浓硫酸与铜加热反应后,铜片有剩余,硫酸反应完全
③浓硫酸具有脱水性,因而能使蔗糖、纸张等炭化
④浓硫酸与铁加热反应后,铁片有剩余,生成的气体中除水蒸气外只有氢气
⑤浓硫酸在常温下能使用铁制或铝制容器盛放.
| A. | ①③⑤ | B. | ③⑤ | C. | ②③④ | D. | ①④⑤ |
3.在学习了物质及其变化之后,某学习小组认为化学反应反应中的先后顺序很重要.他们归纳了下面一些情况,你认为正确的是( )
| A. | 向浓度为0.1 mol/L 的FeI2溶液中通入Cl2,Fe2+先反应 | |
| B. | 向NH4Al(SO4)2溶液中滴加少量的NaOH溶液,NH4+先反应 | |
| C. | 向浓度均为0.1 mol/L的Na2CO3和NaOH混合溶液通入CO2气体,NaOH先反应 | |
| D. | 向等浓度的FeCl3溶液加入质量相等且颗粒大小相同的铁和铜,铜先反应 |
2.硅单质及其化合物在材料领域中应用广泛.下列说法正确的是:( )
①硅是构成岩石和许多矿物的基本元素
②水泥、玻璃、玛瑙饰物都是硅酸盐制品
③高纯度的硅单质广泛用于光纤通讯
④陶瓷、玻璃、水泥是人类使用量最大的无机非金属材料
⑤硅胶既可做干燥剂也可做催化剂的载体.
①硅是构成岩石和许多矿物的基本元素
②水泥、玻璃、玛瑙饰物都是硅酸盐制品
③高纯度的硅单质广泛用于光纤通讯
④陶瓷、玻璃、水泥是人类使用量最大的无机非金属材料
⑤硅胶既可做干燥剂也可做催化剂的载体.
| A. | ①④⑤ | B. | ②③ | C. | ②④⑤ | D. | ①③④ |
1.符合题目要求并且正确的离子方程式的是( )
0 170197 170205 170211 170215 170221 170223 170227 170233 170235 170241 170247 170251 170253 170257 170263 170265 170271 170275 170277 170281 170283 170287 170289 170291 170292 170293 170295 170296 170297 170299 170301 170305 170307 170311 170313 170317 170323 170325 170331 170335 170337 170341 170347 170353 170355 170361 170365 170367 170373 170377 170383 170391 203614
| A. | 氢氧化钡溶液与硫酸镁溶液反应:Ba2++SO42-═BaSO4↓ | |
| B. | 澄清石灰水与少量苏打溶液混合:Ca2++OH-+HCO3-═CaCO3↓+H2O | |
| C. | 硫酸铝溶液中加入过量氨水:Al3++3NH3•H2O═Al(OH)3↓+3NH4+ | |
| D. | 铁屑与足量稀硝酸反应:Fe+2H+═Fe2++H2↑ |
 实验室制取氯气,并用氯气与金属钠反应.装置如图所示,微型烧杯中固体KMnO4与滴入浓盐酸反应的化学方程式是:
实验室制取氯气,并用氯气与金属钠反应.装置如图所示,微型烧杯中固体KMnO4与滴入浓盐酸反应的化学方程式是: