题目内容
1.符合题目要求并且正确的离子方程式的是( )| A. | 氢氧化钡溶液与硫酸镁溶液反应:Ba2++SO42-═BaSO4↓ | |
| B. | 澄清石灰水与少量苏打溶液混合:Ca2++OH-+HCO3-═CaCO3↓+H2O | |
| C. | 硫酸铝溶液中加入过量氨水:Al3++3NH3•H2O═Al(OH)3↓+3NH4+ | |
| D. | 铁屑与足量稀硝酸反应:Fe+2H+═Fe2++H2↑ |
分析 A.漏写生成氢氧化镁的离子反应;
B.苏打为碳酸钠,且完全反应;
C.反应生成氢氧化铝和硫酸铵;
D.反应生成硝酸铁、NO和水.
解答 解:A.氢氧化钡溶液与硫酸镁溶液反应的离子反应为Mg2++2OH-+Ba2++SO42-═BaSO4↓+Mg(OH)2↓,故A错误;
B.澄清石灰水与少量苏打溶液混合的离子反应为Ca2+CO32-═CaCO3↓,故B错误;
C.硫酸铝溶液中加入过量氨水的离子反应为Al3++3NH3•H2O═Al(OH)3↓+3NH4+,故C正确;
D.铁屑与足量稀硝酸反应的离子反应为Fe+4H++NO3-═Fe3++H2O+NO↑,故D错误;
故选C.
点评 本题考查离子反应方程式书写的正误判断,为高频考点,把握发生的反应及离子反应的书写方法为解答的关键,侧重复分解反应、氧化还原反应的离子反应考查,注意离子反应中保留化学式的物质及电子、电荷守恒分析,题目难度不大.

练习册系列答案
相关题目
11.在元素周期表中前18号元素中,其原子的最外层电子数是最内层电子数2k倍的(k为正整数)共有( )
| A. | 2种 | B. | 4种 | C. | 6种 | D. | 8种 |
12.下列每一序号代表一种元素.元素①是常见的过渡元素,其氧化物呈黑色且只有磁性.元素②-⑤性质如表1和元素⑥-⑩在周期表中的位置如表2所示,请回答下列有关问题:
表1
表2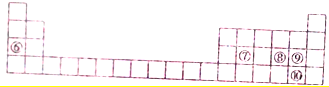
(1)元素⑩的名称是溴;元素⑤的简单离子的结构示意图是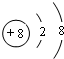 ;所给元素中,其含氧化合物能用于漂白,该元素可能是S、Cl(填元素符号)
;所给元素中,其含氧化合物能用于漂白,该元素可能是S、Cl(填元素符号)
(2)元素④在周期表中的位置是第二周期VA族,该元素的氢化物与元素⑤的单质在高温催化剂条件下反应的化学方程式为4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O
(3)元素②、③、⑥的离子的氧化性由强到弱的顺序为Al3+>Mg2+>Na+(填离子符号);元素③的单质与元素①的磁性氧化物咋高温条件下发生反应的化学方程式为3Fe3O4+8Al$\frac{\underline{\;高温\;}}{\;}$9Al+4Al2O3
(4)元素⑥的焰色反应为黄色,该元素的单质在元素⑤的单质中燃烧的产物含量的化学键为离子键、共价键
(5)元素⑦、⑧、⑨的氢化物的稳定性由弱到强的顺序为SiH4<H2S<HCl(填化学式),设计实验证明单质氧化性顺序为⑩>⑧取少量硫化钠溶液于试管中,滴加溴水,试管中出现淡黄色沉淀,证明Br2的氧化性比S的强.
表1
| 元素符号 | ② | ③ | ④ | ⑤ |
| 原子半径 | 130 | 118 | 75 | 73 |
| 主要化合价 | +2 | +3 | +5、+3、-3 | -2 |

(1)元素⑩的名称是溴;元素⑤的简单离子的结构示意图是
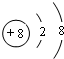 ;所给元素中,其含氧化合物能用于漂白,该元素可能是S、Cl(填元素符号)
;所给元素中,其含氧化合物能用于漂白,该元素可能是S、Cl(填元素符号)(2)元素④在周期表中的位置是第二周期VA族,该元素的氢化物与元素⑤的单质在高温催化剂条件下反应的化学方程式为4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O
(3)元素②、③、⑥的离子的氧化性由强到弱的顺序为Al3+>Mg2+>Na+(填离子符号);元素③的单质与元素①的磁性氧化物咋高温条件下发生反应的化学方程式为3Fe3O4+8Al$\frac{\underline{\;高温\;}}{\;}$9Al+4Al2O3
(4)元素⑥的焰色反应为黄色,该元素的单质在元素⑤的单质中燃烧的产物含量的化学键为离子键、共价键
(5)元素⑦、⑧、⑨的氢化物的稳定性由弱到强的顺序为SiH4<H2S<HCl(填化学式),设计实验证明单质氧化性顺序为⑩>⑧取少量硫化钠溶液于试管中,滴加溴水,试管中出现淡黄色沉淀,证明Br2的氧化性比S的强.
9.NA为阿伏加德罗常数,下列叙述正确的是( )
| A. | 11.2 L氧气中所含有的原子数为NA | |
| B. | 标准状况下,22.4LCCl4所含分子数为NA | |
| C. | 7.8g的Na2O2中含有的阴离子的数目为0.2NA | |
| D. | 27g Al分别与足量的稀硫酸及氢氧化钠溶液反应失去的电子数都是3NA |
6.已知氨的催化氧化法制取硝酸的第一步反应:4NH3+5O2═4NO+6H2O(g),当反应中有m个电子转移时,下列说法正确的是(设NA为阿伏加德罗常数)( )
| A. | 生成水蒸气体积为6.72m/NA L | B. | 参加反应的氨气为m/5 mol | ||
| C. | 生成NO的质量为6mNA g | D. | 发生还原反应的原子数为m/2 个 |
13.下列现象不能用有机物鉴别的是( )
| A. | 遇碘单质是否变蓝-淀粉和纤维素 | |
| B. | 遇浓硝酸是否变黄-某些蛋白质和油脂 | |
| C. | 与氯气混合后光照,气体颜色是否逐渐变浅-甲烷和乙烷 | |
| D. | 与新制的氢氧化铜共热是否产生砖红色沉淀-葡萄糖和蔗糖 |
10.下列反应中,属于加成反应的是( )
| A. | CH2═CH2+HCl→CH3CH2Cl | B. | 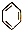 +HO-NO2$→_{55~60℃}^{浓H_{2}SO_{4}}$ +HO-NO2$→_{55~60℃}^{浓H_{2}SO_{4}}$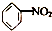 +H2O +H2O | ||
| C. | nCH2═CH2$\stackrel{一定条件}{→}$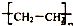 | D. | (C6H10O5)n+nH2O$\stackrel{一定条件}{→}$nC6H12O6 |