题目内容
9.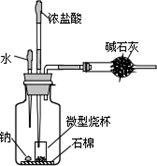 实验室制取氯气,并用氯气与金属钠反应.装置如图所示,微型烧杯中固体KMnO4与滴入浓盐酸反应的化学方程式是:
实验室制取氯气,并用氯气与金属钠反应.装置如图所示,微型烧杯中固体KMnO4与滴入浓盐酸反应的化学方程式是:2KMnO4+16HCl(浓)═2KCl+2MnCl2+5Cl2↑+8H2O
根据题意回答下列问题.
(1)实验室少量金属钠保存在煤油中,取用一小块金属钠要用到的仪器有镊子、小刀、滤纸、玻璃片;
(2)挤压吸有浓盐酸的滴管,反应一段时间后,向金属钠表面加入一滴水,金属钠即发生燃烧,金属钠在氯气中燃烧的现象是有黄色火焰,生成大量白烟,干燥管中碱石灰的作用是吸收未反应的氯气,防止污染;
(3)反应结束后,用注射器从装水滴管胶头插入针头,向广口瓶中加入水,待瓶内气体变为无色后,打开瓶塞,小心取出微型烧杯,广口瓶里溶液中一定含有(H+和OH_除外)Na+、Cl-、ClO-离子(填写离子符号);
(4)欲测试广口瓶中溶液的酸碱性,不宜用pH试纸的理由是溶液中可能含有HClO具有漂白性;
(5)某同学认真分析了该实验装置后,认为实验时可能不安全,有一定危险,该同学得出此结论的理由是钠与水反应生成的氢气与氯气遇明火(点燃)可能爆炸.
分析 (1)钠极易和氧气、水反应,所以保存时要隔绝空气和水;根据各种仪器的作用选取仪器;
(2)金属钠在氯气中燃烧的现象是放出淡黄色的火焰,生成大量白烟;干燥管中碱石灰的作用是吸收没有反应的氯气,防止污染空气;
(3)根据先发生钠与水反应生成氢氧化钠和氢气,后钠与氯气反应生成氯化钠,最后氯气与生成的氢氧化钠反应来分析;
(4)根据氯气溶于水形成氯水具有漂白性分析;
(5)根据开始钠与水反应生成氢氧化钠和氢气,氢气与氯气在点燃时可能发生爆炸来分析.
解答 解:(1)钠极易和空气、水反应,且密度较小,所以保存钠要隔绝空气和水,钠的密度大于煤油且和煤油不反应,所以钠保存在煤油中;
取用钠时,用镊子夹取钠,用小刀切割钠,用滤纸吸收煤油,将钠放置在玻璃片上切割;
故答案为:煤油;玻璃片;
(2)金属钠在氯气中燃烧的现象是放出淡黄色的火焰,生成大量白烟;干燥管中碱石灰的作用是吸收没有反应的氯气,防止污染空气;
故答案为:淡黄色的火焰,生成大量白烟;吸收没有反应的氯气,防止污染空气;
(3)向金属钠表面加入一滴水,金属钠即发生燃烧,则先发生钠与水反应生成氢氧化钠和氢气,后钠与氯气反应生成氯化钠,用注射器从装水滴管胶头插入针头,向广口瓶中加入水,待瓶内气体变为无色后,则生成的氯气与氢氧化钠反应生成氯化钠、次氯酸钠和水,所以广口瓶里溶液中一定含有Na+、Cl-、ClO-,
故答案为:Na+、Cl-、ClO-;
(4)装置中氯气溶于水形成氯水含有HClO具有漂白性,所以不宜用pH试纸,故答案为:溶液中可能含有HClO具有漂白性;
(5)因为开始钠与水反应生成氢氧化钠和氢气,氢气与氯气在点燃时可能发生爆炸,所以有一定危险,故答案为:钠与水反应生成的氢气与氯气遇明火(点燃)可能爆炸.
点评 本题考查了钠的性质、实验室制取氯气等知识点,根据钠和水反应原理、氯气与水反应等知识来分析解答,难度不大.

 阅读快车系列答案
阅读快车系列答案| A. | 棉花 | B. | 塑料 | C. | 蚕丝 | D. | 羊毛 |

| A. | 该电池的正极为锌 | |
| B. | 该电池反应中二氧化锰起催化剂作用 | |
| C. | 当0.1molZn完全溶解时,流经电解质溶液的电子个数为1.204×1023 | |
| D. | 电池正极反应式为:2MnO2+2e-+2H2O═2MnO(OH)+2OH- |
①浓硫酸具有强氧化性,SO2具有强还原性,所以浓硫酸不能干燥SO2气体
②浓硫酸与铜加热反应后,铜片有剩余,硫酸反应完全
③浓硫酸具有脱水性,因而能使蔗糖、纸张等炭化
④浓硫酸与铁加热反应后,铁片有剩余,生成的气体中除水蒸气外只有氢气
⑤浓硫酸在常温下能使用铁制或铝制容器盛放.
| A. | ①③⑤ | B. | ③⑤ | C. | ②③④ | D. | ①④⑤ |
①在高温下,向金红石与焦炭的混合物中通入Cl2,得到TiCl4和一种可燃气体;
②在稀有气体(如氩)氛围和加热的条件下,用镁与TiCl4反应可得到钛.
下列说法不正确的是( )
| A. | 反应①、②均为氧化还原反应 | |
| B. | 在反应①中金红石和焦炭均为还原剂 | |
| C. | 反应①中可燃性气体是CO | |
| D. | 反应②中有1molTi生成时,转移4mol e- |
| A. | 乙酸乙酯与氢氧化钠溶液反应:CH3COOCH2CH3+OH-$\stackrel{△}{→}$CH3COO-+CH3CH2O-+H2O | |
| B. | 向CH2BrCOOH中加入足量的氢氧化钠溶液并加热:CH2BrCOOH+OH-$\stackrel{△}{→}$CH2BrCOO-+H2O | |
| C. | 苯酚钠溶液中通入少量二氧化碳:CO2+H2O+2C6H5O-→2C6H5OH+2CO32- | |
| D. | 乙醛溶液与新制氢氧化铜碱性悬浊液共热:CH3CHO+2Cu(OH)2+OH-$\stackrel{△}{→}$ CH3COO-+Cu2O↓+3H2O |
| A. | 溴苯 | B. | 苯 | C. | 乙醇 | D. | 硝基苯 |
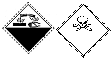 该标志的含义是( )
该标志的含义是( )| A. | 自燃物品、有毒 | B. | 腐蚀品、有毒 | C. | 爆炸性、腐蚀品 | D. | 腐蚀品、氧化剂 |
 病人输液用的葡萄糖注射液是葡萄糖(化学式为C6H12O6)的水溶液,其标签上的部分内容如图所示.利用标签信息,回答下列问题(葡萄糖稀溶液的密度约为1g/cm3):
病人输液用的葡萄糖注射液是葡萄糖(化学式为C6H12O6)的水溶液,其标签上的部分内容如图所示.利用标签信息,回答下列问题(葡萄糖稀溶液的密度约为1g/cm3):