题目内容
4.下列有关浓硫酸的叙述完全正确的一组是:( )①浓硫酸具有强氧化性,SO2具有强还原性,所以浓硫酸不能干燥SO2气体
②浓硫酸与铜加热反应后,铜片有剩余,硫酸反应完全
③浓硫酸具有脱水性,因而能使蔗糖、纸张等炭化
④浓硫酸与铁加热反应后,铁片有剩余,生成的气体中除水蒸气外只有氢气
⑤浓硫酸在常温下能使用铁制或铝制容器盛放.
| A. | ①③⑤ | B. | ③⑤ | C. | ②③④ | D. | ①④⑤ |
分析 ①浓硫酸具有强氧化性,但不能氧化二氧化硫;
②只有浓硫酸才能与铜反应;
③浓硫酸能使蔗糖炭化体现了它的脱水性;
④铁与浓硫酸在加热条件下反应生成二氧化硫,体现浓硫酸的强氧化性,铁与稀硫酸反应生成氢气;
⑤浓硫酸具有强的氧化性,常温下使铁铝发生钝化.
解答 解:①浓硫酸具有强氧化性,二氧化硫具有还原性,但不能氧化二氧化硫,所以能干燥二氧化硫,故错误;
②浓硫酸与铜加热反应后,随着反应进行,浓硫酸浓度降低,变为稀硫酸,不与铜反应,所以铜片有剩余,硫酸不可能反应完全,故错误;
③浓硫酸能使蔗糖中的H、O元素以2:1水的形式脱去,从而使蔗糖碳化,该现象体现浓硫酸的脱水性,故正确;
④铁与浓硫酸在加热条件下反应生成二氧化硫,体现浓硫酸的强氧化性,铁与稀硫酸反应生成氢气,所以既有氢气又有二氧化硫生成,故错误;
⑤浓硫酸具有强的氧化性,常温下使铁铝发生钝化,能使用铁制或铝制容器盛放,故正确;
故选:B.
点评 本题考查了物质的性质,熟悉浓硫酸的强氧化性、脱水性、吸水性是解题关键,题目难度不大,注意钝化属于化学变化.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
14.在同温同压下,下列各组热化学方程式中,△H1<△H2的是( )
| A. | 2H2(气)+O2(气)═2H2O(气)△H1 2H2(气)+O2(气)═2H2O(液)△H2 | |
| B. | S(气)+O2(气)═SO2(气)△H1 S(固)+O2(气)═SO2(气)△H2 | |
| C. | C(固)+$\frac{1}{2}$O2 (气)═CO(气)△H1 C(固)+O2 (气)═CO2(气)△H2 | |
| D. | H2(气)+Cl2(气)═2HCl(气)△H1 $\frac{1}{2}$H2(气)+$\frac{1}{2}$Cl2(气)=HCl(气)△H 2 |
15.如图装置所示,负极上发生的反应为( )


| A. | Zn2++2e-═Zn | B. | Zn-2e-═Zn2+ | C. | Cu-2e-═Cu2+ | D. | Cu2++2e-═Cu |
12.“84”消毒液在日常生活中使用广泛,该消毒液无色,有漂白作用.它的有效成份是下列物质中的一种,这种物质是( )
| A. | KMnO4 | B. | Na2O2 | C. | NH3•H2O | D. | NaClO |
13.某兴趣小组为研究电池原理,设计如图装置.以下叙述不正确的是( )
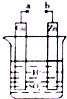

| A. | a和b不连接时,无电流产生,Zn片表面有气泡逸出 | |
| B. | a和b用导线连接,有电流产生,Cu片表面有气泡逸出 | |
| C. | 无论a和b是否连接,Zn片均被腐蚀,溶液的pH均减小 | |
| D. | 若将装置中H2SO4溶液换成CuSO4溶液仍然可以设计成原电池 |
14.科学家在研究化学物质时,常常对物质进行分类,以便对同类物质的组成和性质进行深入研究.下列各组物质中有一种物质从化学性质角度看与其它物质不属于同一类,请将其挑出来,并说明余下的物质属于哪一类.
| 物质组 | 不属于同类的物质 | 余下的物质属于哪一类物质 |
| (1)MgO、CaO、Na2O、AL2O3 | Al2O3 | 碱性氧化物 |
| (2)CO、CO2、SO2、SiO2 | CO | 酸性氧化物 |
| (3)HClO、H2SO4、HNO3、H3PO4 | H3PO4 | 强酸 |
 实验室制取氯气,并用氯气与金属钠反应.装置如图所示,微型烧杯中固体KMnO4与滴入浓盐酸反应的化学方程式是:
实验室制取氯气,并用氯气与金属钠反应.装置如图所示,微型烧杯中固体KMnO4与滴入浓盐酸反应的化学方程式是: