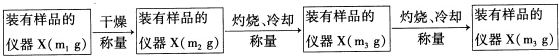
10.化学反应前后发生变化的是( )
| A. | 原子个数 | B. | 元素种类 | C. | 质量 | D. | 化学键 |
4.微生物燃料电池因具有原料广泛、操作条件温和、清洁高效和资源利用率高、无污染等特点而被人们所重视.以用葡萄糖作底物的燃料电池为例,其正负极反应式如下:
正极反应:6O2+24H++24e-$\frac{\underline{\;催化剂\;}}{\;}$12H2O
负极反应:C6H12O6+6H2O-24e-$\frac{\underline{\;催化剂\;}}{\;}$6CO2↑+24H+
则有关该电池的下列说法正确的是( )
0 170170 170178 170184 170188 170194 170196 170200 170206 170208 170214 170220 170224 170226 170230 170236 170238 170244 170248 170250 170254 170256 170260 170262 170264 170265 170266 170268 170269 170270 170272 170274 170278 170280 170284 170286 170290 170296 170298 170304 170308 170310 170314 170320 170326 170328 170334 170338 170340 170346 170350 170356 170364 203614
正极反应:6O2+24H++24e-$\frac{\underline{\;催化剂\;}}{\;}$12H2O
负极反应:C6H12O6+6H2O-24e-$\frac{\underline{\;催化剂\;}}{\;}$6CO2↑+24H+
则有关该电池的下列说法正确的是( )
| A. | 该电池的工作环境是高温条件 | |
| B. | 作为负极的葡萄糖(C6H12O6)在变化中失去电子,被还原 | |
| C. | 该电池的电解质溶液是强酸性溶液,如浓硫酸或硝酸等 | |
| D. | 该电池的总反应为C6H12O6+6O2$\frac{\underline{\;催化剂\;}}{\;}$6CO2+6H2O |
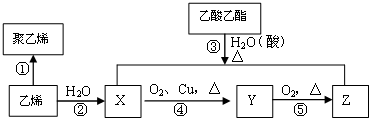
 二甲醚(CH3OCH3)是一种重要的精细化工产品,被认为是二十一世纪最有潜力的燃料,已知:CH3OCH3(g)+3O2(g)=2CO2(g)+3H2O(1)△H=-1455KJ/mol.工业上制备二甲醚的主要方法经历了三个阶段:
二甲醚(CH3OCH3)是一种重要的精细化工产品,被认为是二十一世纪最有潜力的燃料,已知:CH3OCH3(g)+3O2(g)=2CO2(g)+3H2O(1)△H=-1455KJ/mol.工业上制备二甲醚的主要方法经历了三个阶段:


 .
. ,
, .
. .
. )发生酯化反应而生成的,写出F→G的反应的化学方程式CH2=C(CH3)COOCH2CH2OH+
)发生酯化反应而生成的,写出F→G的反应的化学方程式CH2=C(CH3)COOCH2CH2OH+
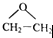 ,该反应的原子利用率为100%,其化学方程式为2CH2=CH2+O2$→_{△}^{Ag}$2
,该反应的原子利用率为100%,其化学方程式为2CH2=CH2+O2$→_{△}^{Ag}$2

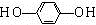 .
.