20. 一定温度下,2L的密闭容器中,发生反应:A2(g)+3B2(g)?2AB3(g).A2在5min内物质的量由12mol变成了4mol.
一定温度下,2L的密闭容器中,发生反应:A2(g)+3B2(g)?2AB3(g).A2在5min内物质的量由12mol变成了4mol.
(1)该反应在这5min内的平均反应速率v(A2)=0.8 mol/(L•min).
(2)经过一段时间反应达到化学平衡状态,下列说法能充分说明该反应已达到化学平衡状态的是④.(填序号)
①A2、B2、AB3的浓度相等 ②正、逆反应速率均等于零
③A2、B2、AB3在容器中共存 ④A2、B2、AB3的浓度均不再改变
(3)下列条件不能改变该化学反应的限度的是④.(填序号)
①温度 ②浓度 ③压强 ④催化剂
(4)下列与改变化学反应速率无关的是③.(填序号)
①将食物存放在温度低的地方
②淀粉在淀粉酶的作用下发生水解反应
③铁粉与水蒸气的反应中,增加铁粉的用量
④将两种块状固体药品研细并混匀后再进行反应
(5)实验室可以利用稀硫酸与锌反应制取氢气.
①实验室用30%的稀硫酸溶液与锌粒反应制取氢气,反应进行一段时间后,气泡边得稀少了,锌粒还有剩余,再添加一些适当浓度的硫酸溶液到反应容器中,气泡又增多,其原因是浓度越大反应速率快.
②某学生为了探究锌与稀硫酸反应过程中速率变化.在100mL稀硫酸中加入足量的锌粉,标准状况下测得数据累计值如下:
在0~1、1~2、2~3、3~4、4~5min时间段中,反应速率最快的时间段是2~3min;0~5min内,化学反应速率变化的原因是H+浓度变小.
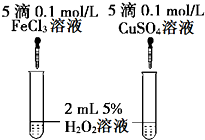
(6)经研究知Cu2+对H2O2分解具有催化作用,为比较Fe3+和Cu2+对H2O2分解的催化效果,某研究小组的同学设计了如图甲、乙所示的实验.通过观察反应产生气泡的快慢,可定性比较得出结论.有同学提出将FeCl3改为Fe2(SO4)3更为合理,其理由是控制阴离子相同,排除阴离子的干扰.
 一定温度下,2L的密闭容器中,发生反应:A2(g)+3B2(g)?2AB3(g).A2在5min内物质的量由12mol变成了4mol.
一定温度下,2L的密闭容器中,发生反应:A2(g)+3B2(g)?2AB3(g).A2在5min内物质的量由12mol变成了4mol.(1)该反应在这5min内的平均反应速率v(A2)=0.8 mol/(L•min).
(2)经过一段时间反应达到化学平衡状态,下列说法能充分说明该反应已达到化学平衡状态的是④.(填序号)
①A2、B2、AB3的浓度相等 ②正、逆反应速率均等于零
③A2、B2、AB3在容器中共存 ④A2、B2、AB3的浓度均不再改变
(3)下列条件不能改变该化学反应的限度的是④.(填序号)
①温度 ②浓度 ③压强 ④催化剂
(4)下列与改变化学反应速率无关的是③.(填序号)
①将食物存放在温度低的地方
②淀粉在淀粉酶的作用下发生水解反应
③铁粉与水蒸气的反应中,增加铁粉的用量
④将两种块状固体药品研细并混匀后再进行反应
(5)实验室可以利用稀硫酸与锌反应制取氢气.
①实验室用30%的稀硫酸溶液与锌粒反应制取氢气,反应进行一段时间后,气泡边得稀少了,锌粒还有剩余,再添加一些适当浓度的硫酸溶液到反应容器中,气泡又增多,其原因是浓度越大反应速率快.
②某学生为了探究锌与稀硫酸反应过程中速率变化.在100mL稀硫酸中加入足量的锌粉,标准状况下测得数据累计值如下:
| 时间(min) | 1 | 2 | 3 | 4 | 5 |
| 氢气体积(mL) | 50 | 120 | 232 | 290 | 310 |
(6)经研究知Cu2+对H2O2分解具有催化作用,为比较Fe3+和Cu2+对H2O2分解的催化效果,某研究小组的同学设计了如图甲、乙所示的实验.通过观察反应产生气泡的快慢,可定性比较得出结论.有同学提出将FeCl3改为Fe2(SO4)3更为合理,其理由是控制阴离子相同,排除阴离子的干扰.
19.若不断地升高温度,实现“雪花→水→水蒸气→氧气和氢气”的变化.在变化的各阶段被破坏的粒子间的相互作用依次是( )
| A. | 氢键; 分子间作用力; 非极性键 | |
| B. | 氢键; 氢键; 极性键 | |
| C. | 氢键; 极性键; 分子间作用力 | |
| D. | 分子间作用力; 氢键; 非极性键 |
18.具有以下结构的原子,一定属于主族元素的是( )
| A. | 最外层有3个未成对电子的原子 | B. | 最外层电子排布为ns2的原子 | ||
| C. | 次外层无未成对电子的原子 | D. | 最外层有8个电子的原子 |
17.目前含有元素硒(Se)的保健品已涌入市场,已知它与氧同主族,而与钙同周期,下列关于硒的有关描述中不正确的是( )
| A. | 原子半径比钙小 | |
| B. | 最高价氧化物为SeO3 | |
| C. | H2Se一定是强酸 | |
| D. | 气态氢化物为H2Se,稳定性比H2S 弱 |
16.下列叙述中错误的是( )
| A. | 金属性:Na>Mg>Al | B. | 原子半径:Cl>Si>O | ||
| C. | 熔点:SiO2>NaCl>SO2 | D. | 酸性:HClO4>H2SO4>H2CO3 |
15.下列说法中,正确的是( )
| A. | 氧气和臭氧互为同分异构体 | B. | 二氧化碳晶体中存在分子间作用力 | ||
| C. | 1H2O和2H2O互为同位素 | D. | 正丁烷和异丁烷互为同系物 |
14.下列氢化物中最稳定的是( )
| A. | HCl | B. | HBr | C. | HI | D. | H2S |
12.下列纯净物中既能跟氢气反应,又能跟高锰酸钾溶液反应,但既不能跟溴水发生加成反应,又不能发生加聚反应的是( )
| A. | 裂化汽油 | B. | 直馏汽油 | C. | 甲苯 | D. | 苯 |
11.下列四种烃的名称所表示的物质,命名正确的是( )
0 170014 170022 170028 170032 170038 170040 170044 170050 170052 170058 170064 170068 170070 170074 170080 170082 170088 170092 170094 170098 170100 170104 170106 170108 170109 170110 170112 170113 170114 170116 170118 170122 170124 170128 170130 170134 170140 170142 170148 170152 170154 170158 170164 170170 170172 170178 170182 170184 170190 170194 170200 170208 203614
| A. | 2-甲基-2-丁烯 | B. | 2-乙基丙烷 | ||
| C. | 3-甲基-2-丁烯 | D. | 2,2-二甲基-3-戊炔 |
