1.由溴乙烷制取乙二醇(HOCH2CH2OH),依次发生的反应类型是( )
| A. | 取代 加成 水解 | B. | 消去 加成 水解 | C. | 水解 消去 加成 | D. | 消去 水解 取代 |
20.在-CH3,-OH,-C6H5和-COOH四种基团中,不同基团两两组合成的化合物中,其水溶液能够与碳酸氢钠反应的有( )
| A. | 1种 | B. | 2种 | C. | 3种 | D. | 4种 |
19.高聚物 的单体是( )
的单体是( )
 的单体是( )
的单体是( )| A. | 氯乙烯 | B. | 氯乙烯和乙烯 | C. |  | D. |  |
18.用分液漏斗无法将下列各组物质分开的是( )
| A. | 甲苯和水 | B. | 溴乙烷和水 | C. | 油酯和水 | D. | 乙醛和水 |
14.下列实验方案正确且能达到相应实验预期目的是( )
| A. |  分离碘酒中的碘和酒精 | B. | 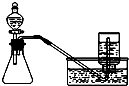 用铜和浓硝酸制取少量NO2 | ||
| C. | 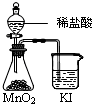 比较MnO2、Cl2、I2的氧化性 | D. | 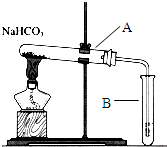 探究NaHCO3的热稳定性 |
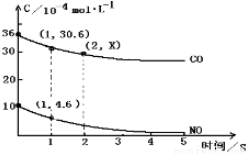
13.NA代表阿伏加德罗常数,下列有关叙述正确的是( )
0 169943 169951 169957 169961 169967 169969 169973 169979 169981 169987 169993 169997 169999 170003 170009 170011 170017 170021 170023 170027 170029 170033 170035 170037 170038 170039 170041 170042 170043 170045 170047 170051 170053 170057 170059 170063 170069 170071 170077 170081 170083 170087 170093 170099 170101 170107 170111 170113 170119 170123 170129 170137 203614
| A. | 常温常压下,6gNO2和40gN2O4混合气体中的原子总数为3NA | |
| B. | 25℃时,pH=13的1.0LBa(OH)2溶液中含有的OH-数目为0.2NA | |
| C. | 在电解食盐水的实验中,测得阴极析出的气体的分子数为0.5NA,则电解后溶液的pH为14 | |
| D. | 64g的铜发生氧化还原反应,一定失去2NA个电子 |