题目内容
18.用分液漏斗无法将下列各组物质分开的是( )| A. | 甲苯和水 | B. | 溴乙烷和水 | C. | 油酯和水 | D. | 乙醛和水 |
分析 只有当两种物质互不相溶时,才能用分液的方法分离,各组物质中,用分液漏斗无法将其分开,说明两种物质间互溶,据此即可解答.
解答 解:A.甲苯和水互不相溶,甲苯在下层,可用分液的方法分离,故A错误;
B.溴乙烷为有机物,和水不溶,能用分液漏斗进行分离,故B错误;
C.油酯为难溶于水的有机物,在水的上层,能用分液漏斗进行分离,故C错误;
D.乙醛是一种无色液体,有刺激性气味,可溶于水,乙醛和水互溶,不能用分液漏斗进行分离,故D正确;
故选D.
点评 本题考查有机物的性质以及物质的分离方法,掌握常见有机物的物理性质以及分离方法是解答的关键,题目难度不大.

练习册系列答案
 优等生题库系列答案
优等生题库系列答案
相关题目
9.3-甲基戊烷的一氯代产物有(不考虑立体异构)( )
| A. | 2种 | B. | 3种 | C. | 4种 | D. | 5种 |
6.某有机样品在氧气中完全燃烧,将反应生成的气体依次通过浓硫酸和碱石灰,浓硫酸增重3.6g,碱石灰增重6.6g,若该有机物可与金属钠反应产生H2,则该有机物样品可能是( )
| A. | 乙醇 | B. | 1-丙醇 | C. | 丙酸 | D. | 丙三醇 |
13.NA代表阿伏加德罗常数,下列有关叙述正确的是( )
| A. | 常温常压下,6gNO2和40gN2O4混合气体中的原子总数为3NA | |
| B. | 25℃时,pH=13的1.0LBa(OH)2溶液中含有的OH-数目为0.2NA | |
| C. | 在电解食盐水的实验中,测得阴极析出的气体的分子数为0.5NA,则电解后溶液的pH为14 | |
| D. | 64g的铜发生氧化还原反应,一定失去2NA个电子 |
3.为鉴定卤代烃中的卤素原子,鉴定实验步骤为:①加入AgNO3溶液;②加入少许卤代烃试样;③加热;④加入NaOH溶液;⑤加入过量的HNO3溶液.正确的操作顺序是( )
| A. | ②④③① | B. | ②③① | C. | ②④③⑤① | D. | ②⑤③① |
10.为检验Na2SO3溶液中是否含有Na2SO4应选用的试剂是( )
| A. | BaCl2溶液 | B. | 稀盐酸、BaCl2溶液 | ||
| C. | 稀硝酸、BaCl2溶液 | D. | 稀硫酸、BaCl2 |
7.下列各组物质中,互为同系物的是( )
| A. | CH3-CH=CH2和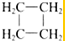 | B. |  和 和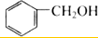 | ||
| C. | 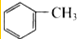 和 和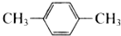 | D. | CH3-CH2-CH=CH2和CH2=CH-CH=CH2 |
8.下表为元素周期表的一部分,请参照元素①~⑨在表中的位置,按要求回答下列问题.
(1)元素①~⑨中,金属性最强的元素是Na(填元素符号).
(2)元素③的原子结构示意图是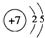 .
.
(3)元素①和②可以形成多种化合物,其中是天然气主要成分的化合物的电子式是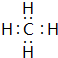 ,该化合物的二氯代物有1种.
,该化合物的二氯代物有1种.
(4)元素⑦、⑧、⑨的最高价氧化物对应的水化物的酸性由强到弱的顺序是HClO4>H2SO4>H2SiO3(填化学式).
(5)下列可以判断元素④和⑨非金属性强弱的是bc(填序号).
a.单质的熔点④比⑨低 b.单质与氢气反应④比⑨剧烈
c.气态氢化物稳定性④比⑨强 d.单质的密度④比⑨小
(6)元素⑥的单质和元素⑤的最高价氧化物对应的水化物的溶液反应,其化学方程式是2Al+2NaOH+2H2O=2NaAlO2+3H2↑.
| 族 周期 | IA | 0 | ||||||
| 1 | ① | IIA | IIIA | IVA | VA | VIA | VIIA | |
| 2 | ② | ③ | ④ | |||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | |||
(2)元素③的原子结构示意图是
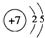 .
.(3)元素①和②可以形成多种化合物,其中是天然气主要成分的化合物的电子式是
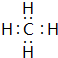 ,该化合物的二氯代物有1种.
,该化合物的二氯代物有1种.(4)元素⑦、⑧、⑨的最高价氧化物对应的水化物的酸性由强到弱的顺序是HClO4>H2SO4>H2SiO3(填化学式).
(5)下列可以判断元素④和⑨非金属性强弱的是bc(填序号).
a.单质的熔点④比⑨低 b.单质与氢气反应④比⑨剧烈
c.气态氢化物稳定性④比⑨强 d.单质的密度④比⑨小
(6)元素⑥的单质和元素⑤的最高价氧化物对应的水化物的溶液反应,其化学方程式是2Al+2NaOH+2H2O=2NaAlO2+3H2↑.