题目内容
16.烟气的脱硫(除SO2)和脱硝(除NO)都是环境科学研究的热点.可以通过氧化还原反应或酸碱反应进行脱硫和脱硝.完成下列填空.(1)烟气中含有一定量的氮氧化物(NO2),可以利用甲烷与NO2一点条件下反应,产物为空气中含有的无害成分,从而消除污染.写出CH4与NO2反应的化学方程式CH4+2NO2$\frac{\underline{\;一定条件\;}}{\;}$N2+CO2+2H2O.
(2)用催化剂可以使NO、CO污染同时降低,2NO(g)+2CO(g)?2CO2(g)+N2(g),根据传感器记录某温度下NO、CO的反应进程,测量所得数据绘制出如图.
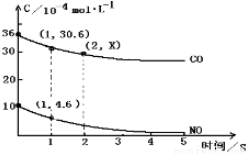
前1s内的平均反应速率v(N2)=2.7×10-4mol/(L.s);第2s时的x值范围30.6>x>25.2;
(3)利用石灰乳和硝酸工业的废气(含NO、NO2)反应,既能净化空气,又能获得应用广泛的Ca(NO2)2,其部分工艺流程如下:
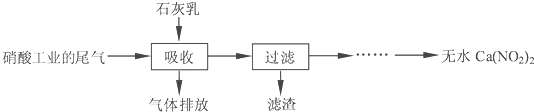
①滤渣可以循环使用,滤渣的主要成分是Ca(OH)2;
②生产中溶液需保持弱碱性,在酸性溶液中Ca(NO2)2会发生分解,产物之一是NO,其反应的离子方程式为3NO2-+2H+=NO3-+2NO↑+H2O.
分析 (1)根据甲烷与NO2一点条件下反应生成空气中含有的无害成分,则根据原子守恒产物为氮气、二氧化碳和水;
(2)利用v=$\frac{△c}{△t}$计算v(CO),根据速率之比等于化学计量数之比求v(N2);根据随着反应进行反应速率越来越小分析;
(3)①滤渣的主要成分是Ca(OH)2;
②根据质量守恒和电荷守恒定律书写.
解答 解:(1)因为甲烷与NO2一点条件下反应生成空气中含有的无害成分,则根据原子守恒产物为氮气、二氧化碳和水,方程式为CH4+2NO2$\frac{\underline{\;一定条件\;}}{\;}$N2+CO2+2H2O,故答案为:CH4+2NO2$\frac{\underline{\;一定条件\;}}{\;}$N2+CO2+2H2O;
(2)一氧化碳的反应速率为v(CO)=$\frac{△c}{△t}$=$\frac{(36-30.6)×10{\;}^{-4}mol/L}{1s}$=5.4×10-4mol/(L.s),同一化学反应同一时间段内,各物质的反应速率之比等于计量数之比,所以v(N2)=$\frac{1}{2}$v(CO)=2.7×10-4mol/(L.s);
因为随着反应进行反应速率越来越小,所以第2S消耗的CO小于第1S的36-30.6=5.4,则第2s时的30.6>x>30.6-5.4=25.2,故答案为:2.7×10-4mol/(L.s);30.6>x>25.2;
(3)①滤渣可以循环使用,则滤渣主要成分是Ca(OH)2,故答案为:Ca(OH)2;
②反应物是NO2-和H+,生成物是一氧化氮,硝酸根和水,反应的离子方程式为3NO2-+2H+=NO3-+2NO↑+H2O,故答案为:3NO2-+2H+=NO3-+2NO↑+H2O.
点评 本题以烟气的脱硫和脱硝为载体,考查环境保护、方程式书写、化学平衡、化学反应速率等,题目难度中等,本题注意把握数据处理能力和图象分析能力.

| A. | 氯化铵和过氧化氢的分解 | B. | 二氧化硅与二氧化碳的熔化 | ||
| C. | 蔗糖和干冰的熔化 | D. | 氯化镁和氯化铝的熔化 |
| A. | 溴乙烷的消去反应:CH3CH2Br+NaOH$→_{△}^{H_{2}O}$CH2═CH2↑+NaBr+H2O | |
| B. | 苯酚钠溶液中通入CO2:2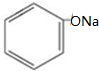 +CO2+H2O→2 +CO2+H2O→2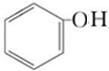 +Na2CO3 +Na2CO3 | |
| C. | 合成聚丙烯塑料:nCH2=CH-CH3$\stackrel{一定条件}{→}$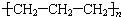 | |
| D. | 乙醛与新制银氨溶液反应:CH3CHO+2Ag(NH3)2OH$\stackrel{水溶液加热}{→}$CH3COONH4+2Ag↓+3NH3+H2O |
| A. | 煤的干馏 | B. | 石油裂解 | ||
| C. | 古代植物变成煤 | D. | 煤焦油中得到苯、甲苯、二甲苯等 |
| A. | 取代 加成 水解 | B. | 消去 加成 水解 | C. | 水解 消去 加成 | D. | 消去 水解 取代 |
| A. | CH2CH2 | B. | CH2=C(CH3)2 | C. | CH3COH | D. | CH3C(CH2)2CH3 |
 );
);