8.某研究小组进行Mg(OH)2沉淀溶解和生成的实验探究.
向2支盛有1mL 1mol/L的MgCl2溶液中各加入10滴2mol/L NaOH,制得等量Mg(OH)2沉淀;然后分别向其中加入不同试剂,记录实验现象如表:
(1)测得实验Ⅰ中所用NH4Cl溶液显酸性(pH约为4.5),用离子方程式解释其显酸性的原因NH4++H2O?NH3•H2O+H+.
(2)同学们猜测实验Ⅰ中沉淀溶解的原因有两种:
猜想1:氢氧化镁电离出OH-离子,与氯化铵电离出来的铵根离子反应生成氨水.
猜想2:氯化铵中NH4+离子水解出的H+,与氢氧化镁电离出OH-离子生成了水.
(3)为验证猜想,又设计了以下实验
①用醋酸铵溶液与氢氧化镁反应的原因是醋酸铵溶液呈中性,如果氢氧化镁能溶解于醋酸铵,说明是NH4+结合氢氧化镁电离出的OH-离子,导致沉淀溶解平衡移动正向移动,达到沉淀溶解.
②实验证明猜想正确的是1(填“1”或“2”).
(4)实验Ⅱ观察到沉淀不溶解.该实验的目的是做对比分析,排除实验中溶剂水使沉淀溶解的可能性.
向2支盛有1mL 1mol/L的MgCl2溶液中各加入10滴2mol/L NaOH,制得等量Mg(OH)2沉淀;然后分别向其中加入不同试剂,记录实验现象如表:
| 实验序号 | 加入试剂 | 实验现象 |
| Ⅰ | 4mL 2mol/L NH4Cl 溶液 | 沉淀溶解 |
| Ⅱ | 4mL蒸馏水 | 沉淀不溶解 |
(2)同学们猜测实验Ⅰ中沉淀溶解的原因有两种:
猜想1:氢氧化镁电离出OH-离子,与氯化铵电离出来的铵根离子反应生成氨水.
猜想2:氯化铵中NH4+离子水解出的H+,与氢氧化镁电离出OH-离子生成了水.
(3)为验证猜想,又设计了以下实验
| 序号 | 实验内容 | 结 果 |
| 1 | 测定醋酸铵溶液的pH | pH约为7,溶液呈中性 |
| 2 | 取少量的相同质量的氢氧化镁分别盛放在试管中,分别向其中滴加醋酸铵溶液和氯化铵溶液 | 固体均溶解 |
②实验证明猜想正确的是1(填“1”或“2”).
(4)实验Ⅱ观察到沉淀不溶解.该实验的目的是做对比分析,排除实验中溶剂水使沉淀溶解的可能性.
6.已知,常温下,Ksp(AgCl)=1.8×10-10,Ksp(AgI)=8.3×10-17,下列叙述中正确的是( )
| A. | 向AgCl的悬浊液中加入KI溶液,沉淀由白色转化为黄色 | |
| B. | 向AgCl的饱和溶液中加入KCl晶体,有AgCl析出且溶液中c(Ag+)=c(Cl-) | |
| C. | 常温下,AgCl在饱和KCl溶液中的Ksp比在纯水中的Ksp小 | |
| D. | 将0.001 mol•L-1的AgNO3溶液滴入NaCl和NaI的混合溶液中,一定先产生AgI沉淀 |
5.下列溶液均处于25℃,有关叙述正确的是( )
| A. | 某物质的水溶液PH<7,则该物质一定是酸或强酸弱碱盐 | |
| B. | pH=4.5的番茄汁中c(H+)是pH=6.5的牛奶中c(H+)的100倍 | |
| C. | 稀释醋酸溶液,溶液中所有离子的浓度均降低 | |
| D. | pH=5.6的CH3COOH与CH3COONa混合溶液中,c(Na+)>c(CH3COO-) |
4.下列反应的离子方程式书写正确的是( )
| A. | NaHS水解:HS-+H2O?S2-+H3O+ | |
| B. | 向硫酸铁溶液中加入铁:Fe3++Fe═2Fe2+ | |
| C. | 在铁上镀铜阳极反应为:Cu2++2e-═Cu | |
| D. | 氯化铜水解:Cu2++2H2O?Cu(OH)2+2H+ |
1.某同学研究金属与不同酸反应的差异,以及影响化学反应速率的元素.
实验药品:2.0mol•L-1盐酸、4.0mol•L-1盐酸、2.0mol•L-1硫酸、4.0mol•L-1硫酸,相同大小的铝片和铝粉(表面氧化膜都已除去).每次实验各种酸的用量均为50.0ml,金属用量均为9.0g.
(1)帮助该同学完成以下实验设计表.
(2)该同学在对比实验Ⅰ、Ⅱ、Ⅴ时发现实验Ⅰ和Ⅱ的反应速度都明显比实验Ⅴ快,你能对问题原因作出哪些假设或猜想(列出一种即可)?答:阴离子对该反应速率的影响.
实验药品:2.0mol•L-1盐酸、4.0mol•L-1盐酸、2.0mol•L-1硫酸、4.0mol•L-1硫酸,相同大小的铝片和铝粉(表面氧化膜都已除去).每次实验各种酸的用量均为50.0ml,金属用量均为9.0g.
(1)帮助该同学完成以下实验设计表.
| 实验目的 | 实验编号 | 温度 | 金属铝形态 | 酸及其浓度 |
| 1.实验Ⅰ和Ⅱ探究盐酸浓度对该反应速率的影响 2.实验Ⅱ和Ⅲ探究:③ 3.实验Ⅱ和Ⅳ探究金属规格(铝片、铝粉)对该反应速率的影响 4.Ⅰ、Ⅱ、Ⅲ实验探究铝与稀盐酸和稀硫酸反应的差异 | Ⅰ | 25℃ | 铝片 | 4.0moL/L盐酸 |
| Ⅱ | 25℃ | 铝片 | 2.0mol•L-1盐酸 | |
| Ⅲ | 35℃ | 铝片 | 2.0mol•L-1盐酸 | |
| Ⅳ | 25℃ | 铝片 | 2.0moL/L盐酸 | |
| Ⅴ | 25℃ | 铝片 | 2.0mol•L-1硫酸 |
20.下表为元素周期表的一部分,表中①-⑩分别代表某一元素.
(1)地壳中含量最多的金属元素是(填序号)⑦.
(2)表中非金属性最强的元素原子半径<④(填“>”或“<”).其离子的结构示意图为: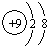 .
.
(3)NaOH溶液不能用带磨口玻璃塞的试剂瓶盛装的原因是(用化学方程式表达)2NaOH+SiO2═Na2SiO3+H2O.
(4)③的气态氢化物与⑩的气体氢化物反应,得到白色晶体M,M中含有的化学键类型有离子键和共价键.
(5)可以验证⑨、⑩非金属性强弱的实验是bc.(填序号)
a.比较它们的单质的硬度和熔点
b.比较相同条件下,它们的单质分别与H2反应飞难易
c.相同条件下,它们的单质分别与铁粉反应,并验证产物中铁元素价态
d.比较它们氢化物水溶液的酸性强弱
(6)如图是由①和②两种元素原子构成的几种分子的球棍模型.

其中,元素②含量最高的是E(填标号,下同);分子中不含双键,但却可以发生加成反应的是E;二氯代物种类最多的是D.
| 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 1 | ① | |||||||
| 2 | ② | ③ | ④ | ⑤ | ||||
| 3 | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ |
(2)表中非金属性最强的元素原子半径<④(填“>”或“<”).其离子的结构示意图为:
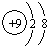 .
.(3)NaOH溶液不能用带磨口玻璃塞的试剂瓶盛装的原因是(用化学方程式表达)2NaOH+SiO2═Na2SiO3+H2O.
(4)③的气态氢化物与⑩的气体氢化物反应,得到白色晶体M,M中含有的化学键类型有离子键和共价键.
(5)可以验证⑨、⑩非金属性强弱的实验是bc.(填序号)
a.比较它们的单质的硬度和熔点
b.比较相同条件下,它们的单质分别与H2反应飞难易
c.相同条件下,它们的单质分别与铁粉反应,并验证产物中铁元素价态
d.比较它们氢化物水溶液的酸性强弱
(6)如图是由①和②两种元素原子构成的几种分子的球棍模型.

其中,元素②含量最高的是E(填标号,下同);分子中不含双键,但却可以发生加成反应的是E;二氯代物种类最多的是D.
19.工业上可用组成为K2O•M2O3•2RO2•nH2O的无机材料纯化制取氢气.元素M、R均位于元素周期表中第3周期,两种元素原子的质子数之和为27,则常温下,不能与M单质发生反应的是( )
0 169806 169814 169820 169824 169830 169832 169836 169842 169844 169850 169856 169860 169862 169866 169872 169874 169880 169884 169886 169890 169892 169896 169898 169900 169901 169902 169904 169905 169906 169908 169910 169914 169916 169920 169922 169926 169932 169934 169940 169944 169946 169950 169956 169962 169964 169970 169974 169976 169982 169986 169992 170000 203614
| A. | CuSO4溶液 | B. | NaOH溶液 | C. | Fe2O3 | D. | 浓硫酸 |
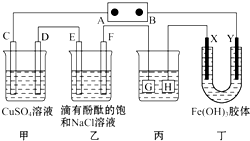 如图所示装置,C,D、E、F、X、Y都是惰性电极,甲、乙中溶液的体积和浓度都相同(假设通电前后溶液体积不变),A、B为外接直流电源的两极,将直流电源接通后,F极附近溶液呈红色.请回答:
如图所示装置,C,D、E、F、X、Y都是惰性电极,甲、乙中溶液的体积和浓度都相同(假设通电前后溶液体积不变),A、B为外接直流电源的两极,将直流电源接通后,F极附近溶液呈红色.请回答: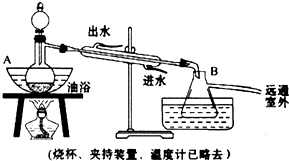 后静置,放出水层(废液).
后静置,放出水层(废液).