题目内容
5.下列溶液均处于25℃,有关叙述正确的是( )| A. | 某物质的水溶液PH<7,则该物质一定是酸或强酸弱碱盐 | |
| B. | pH=4.5的番茄汁中c(H+)是pH=6.5的牛奶中c(H+)的100倍 | |
| C. | 稀释醋酸溶液,溶液中所有离子的浓度均降低 | |
| D. | pH=5.6的CH3COOH与CH3COONa混合溶液中,c(Na+)>c(CH3COO-) |
分析 A.溶液PH小于7的溶液有酸、强酸弱碱盐以及强酸的酸式盐等;
B.根据pH大小可计算出溶液中H+浓度,pH=4.5,c(H+)=10-4.5 mol•L-1,pH=6.5,其c(H+)=10-6.5 mol•L-1;
C.稀释醋酸的过程中,氢离子浓度减小,水的离子积不变,则氢氧根离子浓度增大;
D.pH=5.6的CH3COOH与CH3COONa混合溶液呈酸性,溶液中H+大于OH-浓度,根据溶液呈电中性,则有c(CH3COO-)>c(Na+).
解答 解:A.某些强酸的酸式盐如NaHSO4溶液的pH<7,故A错误;
B.pH=4.5的溶液中c(H+)=10-4.5 mol•L-1,pH=6.5的溶液中c(H+)=10-6.5 mol•L-1,则pH=4.5的番茄汁中c(H+)是pH=6.5的牛奶中c(H+)的100倍,故B正确;
C.稀释醋酸溶液,溶液中氢离子和醋酸根离子浓度减小,由于水的离子积不变,则溶液中氢氧根离子浓度增大,故C错误;
D.混合溶液显酸性,则c(H+)>c (OH-),根据电荷守恒,c(CH3COO-)>c(Na+),故D错误;
故选B.
点评 本题考查了pH的计算、离子浓度大小比较等知识,题目难度中等,涉及盐类的水解、溶液的pH与c(H+)的关系和溶液中离子浓度大小的比较,做题时注意盐溶液类型的积累,能够根据电荷守恒、物料守恒及盐的水解原理正确判断各离子浓度大小.

练习册系列答案
 备战中考寒假系列答案
备战中考寒假系列答案
相关题目
15.下列离子方程式书写正确的是( )
| A. | 碳酸氢钠的水解反应:HCO3-+OH-?CO32-+H2O | |
| B. | 向澄清石灰水中加入盐酸:Ca(OH)2+2H+═Ca2++2H2O | |
| C. | Cl2通入热的KOH溶液中制取KClO3:3Cl2+6OH-$\frac{\underline{\;\;△\;\;}}{\;}$ClO3-+5Cl-+3H2O | |
| D. | 苯酚钠溶液中通入少量CO2:CO2+H2O+2C6H5O-→2C6H5OH+CO32- |
16.用丙醛制取1,2-丙二醇,其合成路线依次发生的反应类型为( )
| A. | 还原→取代→加成→消去 | B. | 氧化→加成→取代→消去 | ||
| C. | 消去→加聚→取代→还原 | D. | 还原→消去→加成→取代 |
13.设NA为阿伏伽德罗常数的值,下列说法错误的是( )
| A. | 0.1molMg2+含有NA个电子 | |
| B. | 1mol•L-1的NaCl溶液中含有NA个Na+ | |
| C. | 2molCu与足量S加热充分反应,转移2NA个电子 | |
| D. | 4gCH4与Cl2在光照条件下反应全部转化为CCl4时,断裂NA个C-H键 |
20.下表为元素周期表的一部分,表中①-⑩分别代表某一元素.
(1)地壳中含量最多的金属元素是(填序号)⑦.
(2)表中非金属性最强的元素原子半径<④(填“>”或“<”).其离子的结构示意图为: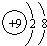 .
.
(3)NaOH溶液不能用带磨口玻璃塞的试剂瓶盛装的原因是(用化学方程式表达)2NaOH+SiO2═Na2SiO3+H2O.
(4)③的气态氢化物与⑩的气体氢化物反应,得到白色晶体M,M中含有的化学键类型有离子键和共价键.
(5)可以验证⑨、⑩非金属性强弱的实验是bc.(填序号)
a.比较它们的单质的硬度和熔点
b.比较相同条件下,它们的单质分别与H2反应飞难易
c.相同条件下,它们的单质分别与铁粉反应,并验证产物中铁元素价态
d.比较它们氢化物水溶液的酸性强弱
(6)如图是由①和②两种元素原子构成的几种分子的球棍模型.

其中,元素②含量最高的是E(填标号,下同);分子中不含双键,但却可以发生加成反应的是E;二氯代物种类最多的是D.
| 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 1 | ① | |||||||
| 2 | ② | ③ | ④ | ⑤ | ||||
| 3 | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ |
(2)表中非金属性最强的元素原子半径<④(填“>”或“<”).其离子的结构示意图为:
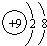 .
.(3)NaOH溶液不能用带磨口玻璃塞的试剂瓶盛装的原因是(用化学方程式表达)2NaOH+SiO2═Na2SiO3+H2O.
(4)③的气态氢化物与⑩的气体氢化物反应,得到白色晶体M,M中含有的化学键类型有离子键和共价键.
(5)可以验证⑨、⑩非金属性强弱的实验是bc.(填序号)
a.比较它们的单质的硬度和熔点
b.比较相同条件下,它们的单质分别与H2反应飞难易
c.相同条件下,它们的单质分别与铁粉反应,并验证产物中铁元素价态
d.比较它们氢化物水溶液的酸性强弱
(6)如图是由①和②两种元素原子构成的几种分子的球棍模型.

其中,元素②含量最高的是E(填标号,下同);分子中不含双键,但却可以发生加成反应的是E;二氯代物种类最多的是D.
17.下列说法正确的是( )
| A. | 最外层有2个电子的元素都是金属元素 | |
| B. | 不管哪一个电子层作为最外层,其电子数都不能超过8个 | |
| C. | 在原子核外的电子层中,电子层大的能量低,电子层小的能量高 | |
| D. | 凡单原子形成的离子,一定具有稀有气体元素原子的核外电子排布 |

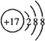 ;
;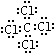 ,分子内含有极性键.
,分子内含有极性键.