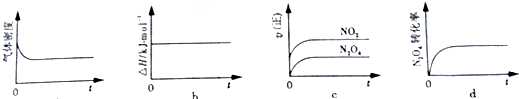
17.常温下,体积、物质的量浓度均相等的四种溶液:①盐酸;②醋酸;③氨水;④CH3COONa溶液.下列说法正确的是( )
| A. | 将①与②分别稀释相同倍数后溶液的pH:①>② | |
| B. | 若②与③混合后溶液呈中性,则在常温下Ka(CH3COOH)=Kb(NH3.NH3) | |
| C. | ③与④中已电离的水分子的数目相等 | |
| D. | ②与④混合所得溶液显酸性,则:c(CH3COO-)+c(OH-)<c(CH3COOH)+c(H+) |
16.绿原酸的结构简式如图所示,下列有关绿原酸的说法不正确的是( )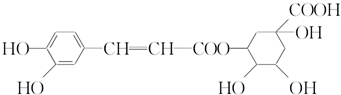
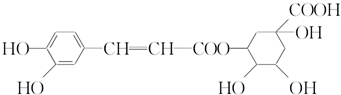
| A. | 分子式为C16H18O9 | |
| B. | 0.1 mol绿原酸最多与0.8 mol NaOH反应 | |
| C. | 能与Na2CO3反应 | |
| D. | 能发生取代反应和消去反应 |
15.下列离子方程式表达正确的是( )
| A. | 向氯化铁溶液中滴加HI溶液:2Fe3++2HI═2Fe2++2H++I2 | |
| B. | 向NH4Al(SO4)2溶液中滴入Ba(0H)2恰好使反应完全:2Ba2++4OH-+Al3++2SO42-═2BaSO4+AlO2-+2H2O | |
| C. | 1mol/L的NaAlO2溶液和2.5 mol/L的HCl等体积均匀混合2AlO2-+5H+═Al(OH)3+Al3++H2O | |
| D. | 用过氧化氢从酸化的海带灰浸出液中提取碘:2I-+H2O2═I2+2OH- |
12.下列有关说法不正确的是( )
| A. | 相同类型的离子晶体,晶格能越大,形成的晶体越稳定 | |
| B. | NH3和H3O+是等电子体,因此结构都是三角锥形 | |
| C. | 邻羟基苯甲醛沸点低于对羟基苯甲醛,原因是前者存在分子内氢键后者存在分子间氢键 | |
| D. | H3O+、HF2-和[Ag(NH3)2]+中均存在配位键 |
10.橙花醇具有玫瑰及苹果香气,可作为香料,其结构简式如图,选项中关于橙花醇的叙述,错误的是( )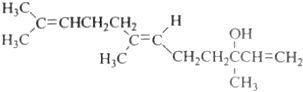

| A. | 橙花醇的分子式C15H26O | |
| B. | 橙花醇在浓硫酸催化下加热脱水,可以生成不止一种四烯烃 | |
| C. | 橙花醇既能发生取代反应,也能发生加成反应和氧化反应 | |
| D. | 1mol 橙花醇在室温下与溴的四氯化碳溶液反应,最多消耗240g溴 |
9.一种基于酸性燃料电池原理设计的酒精检测仪,负极上的反应为:CH3CH2OH-4e-+H2O═CH3COOH+4H+.下列有关说法正确的是( )
0 169797 169805 169811 169815 169821 169823 169827 169833 169835 169841 169847 169851 169853 169857 169863 169865 169871 169875 169877 169881 169883 169887 169889 169891 169892 169893 169895 169896 169897 169899 169901 169905 169907 169911 169913 169917 169923 169925 169931 169935 169937 169941 169947 169953 169955 169961 169965 169967 169973 169977 169983 169991 203614
| A. | 检测时,电解质溶液中的H+向负极移动 | |
| B. | 若有 0.4 mol电子转移,则在标准状况下消耗 4.48 L氧气 | |
| C. | 电池反应的化学方程式为:CH3CH2OH+O2═CH3COOH+H2O | |
| D. | 正极上发生的反应为:O2+4e-+2H2O═4OH- |
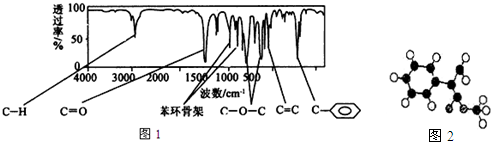
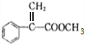 .
.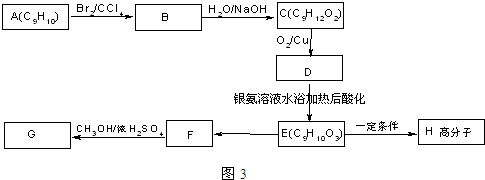
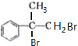 +2NaOH$→_{水}^{△}$
+2NaOH$→_{水}^{△}$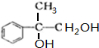 +2NaBr C→D
+2NaBr C→D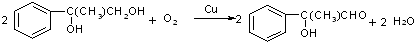 E→Hn
E→Hn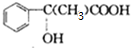 $\stackrel{一定条件}{→}$
$\stackrel{一定条件}{→}$ +(n-1)H2O
+(n-1)H2O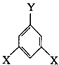 表示(其中X、Y均不为H),试写出符合上述通式且能发生银镜反应的四种物质的结构简式:
表示(其中X、Y均不为H),试写出符合上述通式且能发生银镜反应的四种物质的结构简式: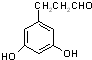 、
、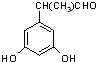 、
、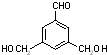 、
、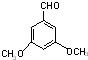 .
.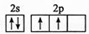 .第四周期与其有相同未成对电子数的过渡金属有Ti、Ni(填元素符号)
.第四周期与其有相同未成对电子数的过渡金属有Ti、Ni(填元素符号)