9.区别植物油和裂化汽油的正确方法是( )
| A. | 加酸性高锰酸溶液,振荡 | B. | 加NaOH溶液,煮沸 | ||
| C. | 加新制Cu(OH)2悬浊液,煮沸 | D. | 加溴水,振荡 |
8. 用0.102 6mol•L-1的盐酸滴定25.00mL未知浓度的氢氧化钠溶液,滴定达终点时,滴定管中的液面如下图所示,正确的读数为( )
用0.102 6mol•L-1的盐酸滴定25.00mL未知浓度的氢氧化钠溶液,滴定达终点时,滴定管中的液面如下图所示,正确的读数为( )
 用0.102 6mol•L-1的盐酸滴定25.00mL未知浓度的氢氧化钠溶液,滴定达终点时,滴定管中的液面如下图所示,正确的读数为( )
用0.102 6mol•L-1的盐酸滴定25.00mL未知浓度的氢氧化钠溶液,滴定达终点时,滴定管中的液面如下图所示,正确的读数为( )| A. | 22.40 mL | B. | 22.30 mL | C. | 23.65 mL | D. | 23.70 mL |
7.下列对沉淀溶解平衡的描述正确的是( )
| A. | 沉淀溶解达到平衡时,沉淀的速率和溶解的速率相等 | |
| B. | 电解质的溶解开始后,只有电解质的溶解过程,没有电解质的析出过程 | |
| C. | 沉淀溶解达到平衡时,溶液中溶质的各离子浓度相等,且保持不变 | |
| D. | 沉淀溶解达到平衡时,如果再加入难溶性的该沉淀物,将促进溶解 |
6.某反应中,A、B浓度随时间的变化如图所示,则表示正确的是( )
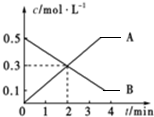

| A. | 前2 min内平均反应速率v(B)=0.3 mol•L-1•min-1 | |
| B. | 当A、B浓度不再变化时,此时反应速率为零 | |
| C. | 该反应的化学方程式为2A?3B | |
| D. | 前2 min内平均反应速率v(A)=0.15 mol•L-1•min-1 |
5.在pH值都等于12的NaOH和CH3COONa两种溶液中,设由水电离产生的OH-离子浓度分别为A mol/L与Bmol/L,则A和B关系为( )
| A. | A>B | B. | A=10-10 B | C. | B=10-4 A | D. | A=B |
4. MOH和ROH两种一元碱的溶液分别加水稀释时,pH变化如图所示.下列叙述中不正确的是( )
MOH和ROH两种一元碱的溶液分别加水稀释时,pH变化如图所示.下列叙述中不正确的是( )
 MOH和ROH两种一元碱的溶液分别加水稀释时,pH变化如图所示.下列叙述中不正确的是( )
MOH和ROH两种一元碱的溶液分别加水稀释时,pH变化如图所示.下列叙述中不正确的是( )| A. | ROH是一种强碱 | B. | 在x点,MOH并没有完全电离 | ||
| C. | 在x点,c(M+)=c(R+) | D. | 稀释前,c(ROH)=10c(MOH) |
2.一定温度下,在三个体积均为1L的密闭容器中发生反应:CO(g)+H2O(g)?CO2(g)+H2(g).下列说法正确的是( )
| 实验编号 | 温度(℃) | 起始物质的量(mol) | 平衡物质的量(mol) | ||
| CO(g) | H2O(g) | CO2(g) | H2(g) | ||
| ① | 430 | 1 | 1 | 0.95 | 0.95 |
| ② | 830 | 1 | 1 | 0.5 | 0.5 |
| ③ | 830 | 1.5 | 1 | ||
| A. | 正反应的△H>0 | B. | CO转化率③>② | ||
| C. | 实验①达到平衡的时间比②短 | D. | 430℃时,该反应的平衡常数为361 |
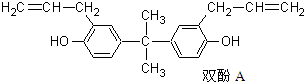
19.双酚A也称BPA(结构如图所示),严重威胁着胎儿和儿童的健康,甚至癌症和新陈代谢紊乱导致的肥胖也被认为与此有关.下列关于双酚A的说法正确的是( )
0 169636 169644 169650 169654 169660 169662 169666 169672 169674 169680 169686 169690 169692 169696 169702 169704 169710 169714 169716 169720 169722 169726 169728 169730 169731 169732 169734 169735 169736 169738 169740 169744 169746 169750 169752 169756 169762 169764 169770 169774 169776 169780 169786 169792 169794 169800 169804 169806 169812 169816 169822 169830 203614

| A. | 该化合物的化学式为C20H24O2 | |
| B. | 该化合物与三氯化铁溶液反应显紫色 | |
| C. | 该化合物的所有碳原子处于同一平面 | |
| D. | 1mol双酚A最多可与4mol Br2发生取代反应 |