15.有铜和氧化铁的混合物a g,当慢慢滴入2mol/L的HCl溶液、边滴边振荡,至50mL时混合物恰好完全溶解.若将a g该混合物在CO气流中加热并充分反应,冷却后剩余固体中铜的质量可能为( )
| A. | 等于(a-0.8 )g | B. | 大于(a-0.8 )g | C. | 大于(a-2.67)g | D. | 等于(a-2.67)g |
14.对物质进行科学分类是化学学习与研究的常用方法.人们在探索物质世界的过程中对酸、碱的概念不断改变和提升.从目前的化学理论看,下列有关说法正确的是( )
| A. | 人们最早先根据味道,来获得朴素的酸、碱概念:酸一定有酸味的,碱一定是有涩味的 | |
| B. | 波义耳基于指示剂变色来分辨酸碱,酸一定能使石蕊变红,碱一定能使石蕊变蓝 | |
| C. | 阿累尼乌斯创立了酸碱电离理论,酸碱电离理论不适用于非水溶液 | |
| D. | 酸碱质子理论:凡是能给出H+的物质就是酸,凡是能结合H+的物质就是碱,这是酸、碱的最终定义 |
13.在一定温度下的在2L密闭容器中加入一定量的炭和水蒸气发生如下反应:C(s)+H2O(g)?CO(g)+H2(g)△H>0,可认定该可逆反应在一定条件下已达到化学平衡状态的是( )
| A. | 容器中H2O、CO、H2的物质的量之比为1:1:1 | |
| B. | v正(CO)=v逆(H2O) | |
| C. | 生成n molCO的同时生成n mol H2 | |
| D. | 1mol H-H键断裂同时生成2mol H-O键 |
12.向蔗糖晶体中加入一定量的浓硫酸,发现蔗糖晶体变黑、膨胀,此过程中浓硫酸没有表现的性质是( )
| A. | 脱水性 | B. | 强氧化性 | C. | 酸性 | D. | 吸水性 |
11.以下粉尘,不具有爆炸危险的是( )
| A. | 面粉 | B. | 铝粉 | C. | 石墨粉 | D. | 岩石粉尘 |
10.NA表示阿伏加德罗常数,下列说法正确的是( )
| A. | 常温常压下,11.2L 二氧化硫气体中含有0.5NA个SO2分子 | |
| B. | 常温下,3.2g硫与足量铁粉充分反应,转移的电子数为0.2 NA个 | |
| C. | 1 mol 苯分子中含有3 NA个碳碳双键 | |
| D. | 0.1mol•L-1的Na2S溶液中含有0.2NA个Na+离子 |
9.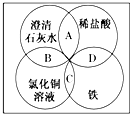 铁、稀盐酸、澄清石灰水、氯化铜溶液是初中化学中常见的物质,四种物质间的反应关系如图所示.图中两圆相交部分(A、B、C、D)表示物质间的反应,其中对应四个反应类型的说法正确的是( )
铁、稀盐酸、澄清石灰水、氯化铜溶液是初中化学中常见的物质,四种物质间的反应关系如图所示.图中两圆相交部分(A、B、C、D)表示物质间的反应,其中对应四个反应类型的说法正确的是( )
 铁、稀盐酸、澄清石灰水、氯化铜溶液是初中化学中常见的物质,四种物质间的反应关系如图所示.图中两圆相交部分(A、B、C、D)表示物质间的反应,其中对应四个反应类型的说法正确的是( )
铁、稀盐酸、澄清石灰水、氯化铜溶液是初中化学中常见的物质,四种物质间的反应关系如图所示.图中两圆相交部分(A、B、C、D)表示物质间的反应,其中对应四个反应类型的说法正确的是( )| A. | 复分解反应、复分解反应、化合反应、置换反应 | |
| B. | 中和反应、置换反应、复分解反应、置换反应 | |
| C. | 复分解反应、复分解反应、置换反应、置换反应 | |
| D. | 分解反应、复分解反应、置换反应、置换反应 |
8.常温下,下列各组离子在指定溶液中能大量共存的是( )
| A. | pH=13的溶液:K+、Na+、Cl-、SiO32- | |
| B. | c(H+)/c(OH-)=1×10-14的溶液:Na+、NH4+、Cl-、SO42- | |
| C. | 0.1mol•L-1的Na2CO3溶液:Na+、Ca2+、I-、SO42- | |
| D. | 加入石蕊呈蓝色的溶液:Na+、Al3+、Cl-、NO3- |
7.下列现象与氢键有关的是( )
①NH3的熔、沸点比第ⅤA族其他元素氢化物的熔、沸点高
②碳原子数较少的醇、羧酸可以和水以任意比互溶
③常温下H2O为液态,而H2S为气态
④水分子高温下也很稳定.
0 169551 169559 169565 169569 169575 169577 169581 169587 169589 169595 169601 169605 169607 169611 169617 169619 169625 169629 169631 169635 169637 169641 169643 169645 169646 169647 169649 169650 169651 169653 169655 169659 169661 169665 169667 169671 169677 169679 169685 169689 169691 169695 169701 169707 169709 169715 169719 169721 169727 169731 169737 169745 203614
①NH3的熔、沸点比第ⅤA族其他元素氢化物的熔、沸点高
②碳原子数较少的醇、羧酸可以和水以任意比互溶
③常温下H2O为液态,而H2S为气态
④水分子高温下也很稳定.
| A. | .①②③④ | B. | .①②③ | C. | ②③④ | D. | .① |