18.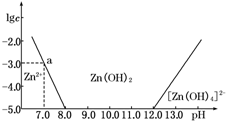 如图所示,横坐标为溶液的pH,纵坐标为Zn2+或[Zn(OH)4]2-的物质的量浓度的对数.回答下列问题:
如图所示,横坐标为溶液的pH,纵坐标为Zn2+或[Zn(OH)4]2-的物质的量浓度的对数.回答下列问题:
(1)往ZnCl2溶液中加入足量的氢氧化钠溶液,反应的离子方程式可表示为Zn2++4OH-═[Zn(OH)4]2-.
(2)从图中数据计算可得Zn(OH)2的溶度积Ksp=10-17.
(3)某废液中含Zn2+,为提取Zn2+可以控制溶液中pH的范围是8.0<pH<12.0.
(4)25℃时,PbCl2浓度随盐酸浓度变化如下表:
根据上表数据判断下列说法正确的是A、B、C、D.
A.随着盐酸浓度的增大,PbCl2固体的溶解度先变小后又变大
B.PbCl2固体在0.50mol/L盐酸中的溶解度小于在纯水中的溶解度
C.PbCl2能与浓盐酸反应生成一种难电离的阴离子(络合离子)
D.PbCl2固体可溶于饱和食盐水.
 如图所示,横坐标为溶液的pH,纵坐标为Zn2+或[Zn(OH)4]2-的物质的量浓度的对数.回答下列问题:
如图所示,横坐标为溶液的pH,纵坐标为Zn2+或[Zn(OH)4]2-的物质的量浓度的对数.回答下列问题:(1)往ZnCl2溶液中加入足量的氢氧化钠溶液,反应的离子方程式可表示为Zn2++4OH-═[Zn(OH)4]2-.
(2)从图中数据计算可得Zn(OH)2的溶度积Ksp=10-17.
(3)某废液中含Zn2+,为提取Zn2+可以控制溶液中pH的范围是8.0<pH<12.0.
(4)25℃时,PbCl2浓度随盐酸浓度变化如下表:
| c(HCl) | |||||||
| (mol/L) | 0.50 | 1.00 | 2.04 | 2.90 | 4.02 | 5.16 | 5.78 |
| 103 c(PbCl2) | |||||||
| (mol/L) | 5.10 | 4.91 | 5.21 | 5.90 | 7.48 | 10.81 | 14.01 |
A.随着盐酸浓度的增大,PbCl2固体的溶解度先变小后又变大
B.PbCl2固体在0.50mol/L盐酸中的溶解度小于在纯水中的溶解度
C.PbCl2能与浓盐酸反应生成一种难电离的阴离子(络合离子)
D.PbCl2固体可溶于饱和食盐水.
15.下列离子方程式正确的是( )
| A. | 用惰性电极电解饱和氯化钠溶液:2Cl-+2H+ $\frac{\underline{\;电解\;}}{\;}$H2↑+Cl2↑ | |
| B. | 用银氨溶液检验乙醛中的醛基: CH3CHO+2Ag(NH3)2++2OH-$\stackrel{水浴加热}{→}$CH3COONH4+3NH3+2Ag↓+H2O | |
| C. | Na2SO3溶液使酸性KMnO4溶液褪色:5SO32-+6H++2MnO4-═5SO42-+2Mn2+ 3H2O | |
| D. | 苯酚钠溶液中通入少量CO2:CO2+H2O+2C6H5O-→2C6H5OH+2CO32- |
14.下列离子方程式正确的是( )
| A. | 金属钠与水反应:Na+2H2O═Na++2OH-+H2↑ | |
| B. | Ag2S沉淀溶解电离方程式:Ag2S(s)?2Ag+(aq)+S2-(aq) | |
| C. | Fe3O4与稀硝酸溶液反应:Fe3O4+8H+═2Fe3++Fe2++4H2O | |
| D. | NaHCO3溶液与足量Ba(OH)2溶液混合:2HCO3-+Ba2++2OH-═BaCO3↓+2H2O+CO32- |
9.下列有关叙述中正确的是( )
0 169530 169538 169544 169548 169554 169556 169560 169566 169568 169574 169580 169584 169586 169590 169596 169598 169604 169608 169610 169614 169616 169620 169622 169624 169625 169626 169628 169629 169630 169632 169634 169638 169640 169644 169646 169650 169656 169658 169664 169668 169670 169674 169680 169686 169688 169694 169698 169700 169706 169710 169716 169724 203614
| A. | 液态氟化氢中存在氢键,所以其分子比氯化氢更稳定 | |
| B. | 由碳、氮原子形成的化合物比金刚石硬,其主要原因是碳氮键比碳碳键更短 | |
| C. | S8和NO2都是共价化合物,NH4Cl和CaC2都是离子化合物 | |
| D. | 若ⅡA某元素的原子序数为m,则同周期ⅢA元素的原子序数有可能为m+10 |
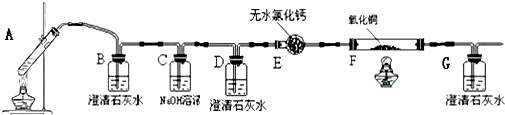
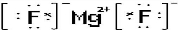 .
.