9.下列反应的离子方程式书写正确的是( )
| A. | 明矾溶液中加入过量的氨水:Al3++4OH-═AlO2-+2H2O | |
| B. | 铜粉与98.3%的硫酸加热下反应 Cu+4H++SO42-$\frac{\underline{\;\;△\;\;}}{\;}$Cu2++SO2↑+2H2O | |
| C. | 氯化亚铁溶液中加入硝酸:3Fe2++4H++NO3-═3Fe3++2H2O+NO↑ | |
| D. | 澄清石灰水中加入少量的NaHCO3溶液:Ca2++2OH-+2HCO3-═CaCO3↓+2H2O+CO32- |
6.下列反应的离子方程式不正确的是( )
| A. | 向烧碱溶液中滴加少量氯化铝溶液:Al3++4OH-═AlO2-+2H2O | |
| B. | 物质的量相等的溴化亚铁跟氯气反应:2Fe2++2Br-+2Cl2═2Fe3++Br2+4Cl- | |
| C. | 硫化钾晶体溶于水:S2-+2H2O?2OH-+H2S | |
| D. | 向碳酸钠溶液中滴加过量的稀硫酸:CO32-+2H+═CO2↑+H2O |
5.实现下列变化既不需要另加入还原剂,也不需要另加入氧化剂的是( )
| A. | F2→F- | B. | HNO3→NO | C. | Mg→Mg2+ | D. | Na2O2→O2 |
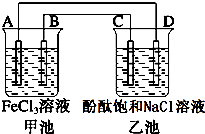
4.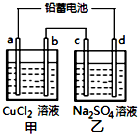 用铅蓄电池电解甲、乙电解池中的溶液.已知铅蓄电池的总反应为:
用铅蓄电池电解甲、乙电解池中的溶液.已知铅蓄电池的总反应为:
Pb(s)+PbO2(s)+2H2SO4(aq)$?_{放电}^{充电}$2PbSO4(s)+2H2O(l)
电解一段时间后向c极和d极附近分别滴加酚酞试剂,c极附近溶液变红,下列说法正确的是( )
0 169453 169461 169467 169471 169477 169479 169483 169489 169491 169497 169503 169507 169509 169513 169519 169521 169527 169531 169533 169537 169539 169543 169545 169547 169548 169549 169551 169552 169553 169555 169557 169561 169563 169567 169569 169573 169579 169581 169587 169591 169593 169597 169603 169609 169611 169617 169621 169623 169629 169633 169639 169647 203614
 用铅蓄电池电解甲、乙电解池中的溶液.已知铅蓄电池的总反应为:
用铅蓄电池电解甲、乙电解池中的溶液.已知铅蓄电池的总反应为:Pb(s)+PbO2(s)+2H2SO4(aq)$?_{放电}^{充电}$2PbSO4(s)+2H2O(l)
电解一段时间后向c极和d极附近分别滴加酚酞试剂,c极附近溶液变红,下列说法正确的是( )
| A. | d极为阴极 | |
| B. | 放电时铅蓄电池负极的电极反应式为:PbO2(s)+4H+(aq)+SO42-(aq)+4e-═PbSO4(s)+2H2O(l) | |
| C. | 若利用甲池精炼铜,b极应为粗铜 | |
| D. | 若四个电极材料均为石墨,当析出6.4gCu时,两池中共产生气体3.36L(标准状况下) |
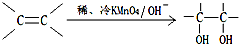 ).在下列转化关系中,P为高分子化合物.
).在下列转化关系中,P为高分子化合物.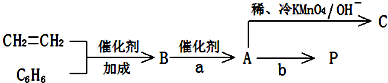
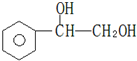 ,C与足量醋酸反应的化学方程式为
,C与足量醋酸反应的化学方程式为 ;
;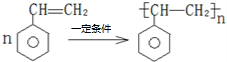 .
. 如图所示,甲池中电池反应式为2Fe3++Cu═2Fe2++Cu2+,反应过程中A电极质量逐渐减小,C、D为石墨电极,乙池中为200mL滴加酚酞的饱和NaCl溶液.回答下列问题:
如图所示,甲池中电池反应式为2Fe3++Cu═2Fe2++Cu2+,反应过程中A电极质量逐渐减小,C、D为石墨电极,乙池中为200mL滴加酚酞的饱和NaCl溶液.回答下列问题: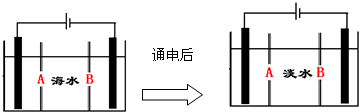
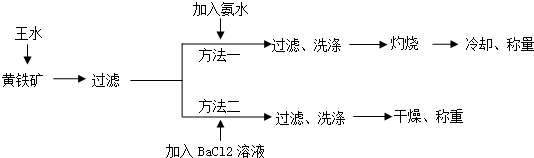
 物质A、E、F的焰色反应呈黄色,物质I的1个分子由4个原子组成并共含有10个电子,B、C、D、K在常温下都是气体单质,G在常温下是无色液体,反应①~⑤都是用于工业生产的反应,各有关物质之间的相互反应转化关系如图所示(部分反应条件已略去):
物质A、E、F的焰色反应呈黄色,物质I的1个分子由4个原子组成并共含有10个电子,B、C、D、K在常温下都是气体单质,G在常温下是无色液体,反应①~⑤都是用于工业生产的反应,各有关物质之间的相互反应转化关系如图所示(部分反应条件已略去):