12.如图为一种原电池,下列有关说法正确的是( )


| A. | 甲中盛硫酸锌溶液,乙中盛硫酸铜溶液,锌为阴极 | |
| B. | 乙中盛硫酸铜溶液,铜离子在铜电极上被氧化 | |
| C. | 电池工作时,盐桥中的阳离子移向甲,阴离子移向乙,溶液仍保持电中性 | |
| D. | 取出盐桥,电流表指针即回到零点 |
8.已知KMnO4与KNO2溶液反应的离子方程式为(未配平):MnO4-+NO2-+□-Mn2++NO3-+H2O.下列说法正确的是( )
0 169306 169314 169320 169324 169330 169332 169336 169342 169344 169350 169356 169360 169362 169366 169372 169374 169380 169384 169386 169390 169392 169396 169398 169400 169401 169402 169404 169405 169406 169408 169410 169414 169416 169420 169422 169426 169432 169434 169440 169444 169446 169450 169456 169462 169464 169470 169474 169476 169482 169486 169492 169500 203614
| A. | MnO4-发生了氧化反应 | |
| B. | 氧化剂与还原剂的物质的量之比为1:3 | |
| C. | 方程式“□”中的应填入OH- | |
| D. | 氧化产物与还原产物物质的量之比是5:2 |
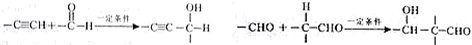

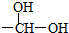 极不稳定,会自动脱水),其中核磁共振氢谱中只出现三组峰的是CH3CH(OH)CH(OH)CH3(写出结构简式).
极不稳定,会自动脱水),其中核磁共振氢谱中只出现三组峰的是CH3CH(OH)CH(OH)CH3(写出结构简式).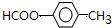 (写出结构简式).
(写出结构简式).

 ;Y和E两元素中第一电离能较大的是(填元素符号)F;X、Y、Q三元素可以形成一种化合物,它与稀盐酸反应的离子方程式是:CaCO3+2H+=Ca2++CO2↑+H2O.
;Y和E两元素中第一电离能较大的是(填元素符号)F;X、Y、Q三元素可以形成一种化合物,它与稀盐酸反应的离子方程式是:CaCO3+2H+=Ca2++CO2↑+H2O. ;在此反应中,氧化剂是MnO2(填化学式,下同),氧化产物是Cl2,其中氧化性较强的是MnO2,盐酸在此反应中的作用是酸、还原剂;要制取标准状况下的氯气2.24升,理论上至少需要10mol/L的浓盐酸的体积为40ml.
;在此反应中,氧化剂是MnO2(填化学式,下同),氧化产物是Cl2,其中氧化性较强的是MnO2,盐酸在此反应中的作用是酸、还原剂;要制取标准状况下的氯气2.24升,理论上至少需要10mol/L的浓盐酸的体积为40ml.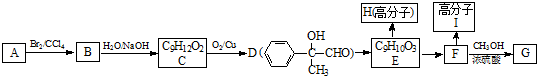
 .
. ;②F→G
;②F→G .
. .
.