题目内容
5.A、B、C均为短周期元素,可形成A2C和BC2两种化合物.A、B、C的原子序数依次递增,A原子的K层的电子数目只有一个,B位于A的下一周期,它的最外层电子数比K层多2个,而C原子核外的最外层电子数比次外层电子数少2个.已知D是第三周期半径最大的原子.E是第三周期半径最小的原子(除去稀有气体)(1)它们的元素符号分别为:AH;BC;CS;
(2)BC2是由极性键键组成的非极性(填“极性”或“非极性”)分子.
(3)在BC2中中心原子采取sp 杂化方式.
(4)A2C分子立体构型是V形.
(5)D与E构成的化合物中D 与E的配位数分别为6和6.该物质的熔点比MgO的熔点低.
分析 A、B、C的原子序数依次递增,A原子的K层的电子数目只有一个,则A为氢元素,B位于A的下一周期,它的最外能层电子数比K层多2个,则B为碳元素,而C原子核外的最外能层电子数比次外层电子数少2个,则C为硫元素;D是第三周期半径最大的原子,则D为Na;E是第三周期半径最小的原子(除去稀有气体),则E为Cl,据此答题.
解答 解:A、B、C的原子序数依次递增,A原子的K层的电子数目只有一个,则A为氢元素,B位于A的下一周期,它的最外能层电子数比K层多2个,则B为碳元素,而C原子核外的最外能层电子数比次外层电子数少2个,则C为硫元素;D是第三周期半径最大的原子,则D为Na;E是第三周期半径最小的原子(除去稀有气体),则E为Cl.
(1)根据上述分析可知,A、B、C的元素符号分别为:H、C、S,故答案为:H;C;S;
(2)CS2的结构与二氧化碳相似,为直线型对称结构,是由极性键组成的非极性分子,故答案为:极性;非极性;
(3)CS2为直线型结构,碳原子中心原子采取sp杂化方式,故答案为:sp;
(4)H2S分子中硫原子有两对孤电子对,形成2个S-H,所以H2S的空间构型为V形,故答案为:V形;
(5)D与E构成的化合物为NaCl,晶体中每个氯离子周围有6个钠离子,每个钠离子周围有6个氯离子,D 与E的配位数分别为6、6,钠离子、氯离子所带电荷小于镁离子、阳离子,离子半径Cl->O2->Na+>Mg2+,故MgO的晶格能更大,熔点更高,
故答案为:6;6;低.
点评 本题是对物质结构的考查,涉及核外电子排布、分子的极性、分子空间构型、杂化方式、晶胞结构、晶体熔点高低比较,难度不大,元素推断是解题的关键,注意熟记中学常见晶体结构.

练习册系列答案
相关题目
13.下列除杂过程中,选用试剂和方法正确的是( )
| A. | 除去乙烷中混有的乙烯,加氯气光照 | |
| B. | 除去乙烯中混有的水蒸气,通过盛浓硫酸的洗气瓶 | |
| C. | 除去乙炔中混有水蒸气,通过盛碱石灰的干燥管 | |
| D. | 除去乙烯中混有的少量SO2,通过KMnO4酸性溶液后再干燥 |
20.下列依据相关实验得出的结论正确的是( )
| A. | 向浓度均为0.1 mol•L-1NaCl和NaI混合溶液中滴加少量AgNO3溶液,产生黄色沉淀,说明Ksp(AgCl)>Ksp(AgI) | |
| B. | 在含FeCl2杂质的FeCl3溶液中通足量Cl2后,充分加热,除去过量的Cl2,即可得到较纯净的FeCl3溶液 | |
| C. | 用激光笔分别照射蛋清溶液和葡萄糖溶液,能产生光亮“通路”的是蛋清溶液 | |
| D. | 用铂丝蘸取某溶液进行焰色反应,透过蓝色钴玻璃观察到火焰呈紫色,该溶液一定是钾盐溶液 |
14.原电池是将化学能直接转化为电能的装置,原电池反应的本质是( )
| A. | 化合价的升降 | B. | 离子定向移动 | C. | 氧化还原反应 | D. | 电能的储存 |
15.短周期元素W、X、Y、Z在元素周期表中的位置如图所示,其中W的单质是空气的主要成分,化学性质稳定,不易参加化学反应,则下列有关说法中错误的是( )
| W | X | ||
| Y | Z |
| A. | 四种元素常见的氢化物:YH4、WH3、H2X、HZ中,YH4最不稳定 | |
| B. | 氢化物WH3与HZ反应生成的化合物是离子化合物 | |
| C. | Y与Z形成的化合物YZ4中存在非极性共价键 | |
| D. | Z元素的最高价氧化物水化物的酸性强于Y |

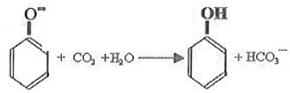

 ;
; .
.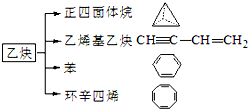 乙炔是一种重要的有机化工原料,以乙炔为原料在不同的反应条件下可以转化成以下化合物.完成下列各题:
乙炔是一种重要的有机化工原料,以乙炔为原料在不同的反应条件下可以转化成以下化合物.完成下列各题: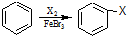 ).
). .
.
