10.已知H2(g)+I2(g)?2HI(g);△H<0.有相同容积的定容密闭容器甲和乙,甲中加入H2和I2各0.1mol,乙中加入HI0.2mol,相同温度下分别达到平衡.欲使甲中HI的平衡浓度大于乙中HI的平衡浓度,应采取的措施是( )
| A. | 甲升高温度,乙不变 | B. | 甲中加入0.1molHe,乙不变 | ||
| C. | 甲、乙提高相同温度 | D. | 甲增加0.1molH2,乙不变 |
9.NA代表阿伏加德罗常数的值.下列有关叙述正确的是( )
| A. | 标准状况下,2.24LC6H14中含有1.9NA个共用电子对 | |
| B. | 7.8gNa2O2固体中含阴离子数目为0.1NA | |
| C. | 含36.5gHCl的浓盐酸与足量的二氧化锰作用,能产生0.25NA个氯气分子 | |
| D. | 5.6gFe与足量的氯气反应转移的电子数目为0.2NA |
8.化学是以实验为基础的自然科学,化学实验设计和操作中必须十分重视师生安全问题和环境保护问题.下列实验问题处理方法正确的是( )
| A. | 制氧气时排水法收集氧气后出现倒吸现象,应立即停止加热 | |
| B. | 在气体发生装置上直接点燃乙炔气体时,不需先检验乙炔气体的纯度 | |
| C. | 白磷在空气中易自燃,用剩的白磷可溶解于CS2后倒入垃圾箱 | |
| D. | 给试管中的液体加热时,可加入碎瓷片或不时移动试管,以免暴沸伤人 |
7.下列离子方程是正确的是( )
| A. | Cu与浓硝酸反应:Cu+4H++4NO3-═Cu2++4NO2↑+2H2O | |
| B. | 氨水与醋酸溶液反应:NH3•H2O+CH3COOH═NH4++CH3COO-+H2O | |
| C. | 过氧化钠溶于水:2O2-+2H2O═4OH-+O2↑ | |
| D. | 小苏打与氢氧化钠溶液混合:HCO3-+OH-═CO2↑+H2O |
6.下列工业生产过程中不涉及氧化还原反应的是( )
①制水泥、玻璃 ②制硝酸 ③制硫酸 ④氯碱工业 ⑤合成氨 ⑥制漂白粉 ⑦制皂.
①制水泥、玻璃 ②制硝酸 ③制硫酸 ④氯碱工业 ⑤合成氨 ⑥制漂白粉 ⑦制皂.
| A. | ①②③⑤ | B. | ①③⑤⑥⑦ | C. | 只有①⑦ | D. | ③⑥⑦ |
5.在研究物质变化时,不但要着眼于物质种类的变化,也要关注物质状态的变化.

(1)高温下水分解体系中主要物质的体积分数与温度的关系如图1所示.下列说法正确的是C
A.图中A、B表示的粒子依次是O和H
B.图中A、B表示的粒子依次是H+和O2-
C.图中A、B重新生成水时的活化能等于0
D.图中A、B重新生成水时的活化能大于0
(2)已知H2的燃烧热△H=-285.8kJ/mol,且H2O的汽化热为44.0kJ/mol.试写出H2燃烧生成水蒸气的热化学方程式H2(g)+$\frac{1}{2}$O2(g)=H2O(g)△H=-241.8kJ/mol.
(3)在容积为2.0L的密闭容器内,物质D在T℃时发生反应,其反应物和生成物的物质的量随时间t的变化关系如图2,据图回答下列问题:
①从反应开始到第一次达到平衡时,用A物质表示的平均反应速率为0.067 mol/(L•min)(保留2位有效数字)
②第5min时,升高温度,A、B、D的物质的量变化如图,则该反应为吸热(填“吸热”或“放热”)反应.
③若在第7min时增加D的物质的量,其他条件不变,则A的物质的量图象变化正确的是b(用图中a、b、c的编号回答)
(4)在100℃、200KPa的条件下,反应aA(g)?bB(g)+cC(g)建立平衡后,在不加入任何物质的条件下,逐步增大体系的压强(维持温度不变),如表列出的是不同压强下反应建立平衡时物质B的浓度.根据表中的数据,回答下列问题:
①比较大小:a= b+c(填“>”、“<”或“=”)
②压强从500KPa增加到1000KPa时,平衡正向移动(填“正向”、“逆向”或“不移动”),其原因可能为压强增大为原来的两倍,B浓度的变化大于两倍,说明C在增大压强时变为非气体,平衡正向移动.

(1)高温下水分解体系中主要物质的体积分数与温度的关系如图1所示.下列说法正确的是C
A.图中A、B表示的粒子依次是O和H
B.图中A、B表示的粒子依次是H+和O2-
C.图中A、B重新生成水时的活化能等于0
D.图中A、B重新生成水时的活化能大于0
(2)已知H2的燃烧热△H=-285.8kJ/mol,且H2O的汽化热为44.0kJ/mol.试写出H2燃烧生成水蒸气的热化学方程式H2(g)+$\frac{1}{2}$O2(g)=H2O(g)△H=-241.8kJ/mol.
(3)在容积为2.0L的密闭容器内,物质D在T℃时发生反应,其反应物和生成物的物质的量随时间t的变化关系如图2,据图回答下列问题:
①从反应开始到第一次达到平衡时,用A物质表示的平均反应速率为0.067 mol/(L•min)(保留2位有效数字)
②第5min时,升高温度,A、B、D的物质的量变化如图,则该反应为吸热(填“吸热”或“放热”)反应.
③若在第7min时增加D的物质的量,其他条件不变,则A的物质的量图象变化正确的是b(用图中a、b、c的编号回答)
(4)在100℃、200KPa的条件下,反应aA(g)?bB(g)+cC(g)建立平衡后,在不加入任何物质的条件下,逐步增大体系的压强(维持温度不变),如表列出的是不同压强下反应建立平衡时物质B的浓度.根据表中的数据,回答下列问题:
| 压强(KPa) | 200 | 500 | 1000 |
| B的浓度(mol/L) | 0.04 | 0.1 | 0.27 |
②压强从500KPa增加到1000KPa时,平衡正向移动(填“正向”、“逆向”或“不移动”),其原因可能为压强增大为原来的两倍,B浓度的变化大于两倍,说明C在增大压强时变为非气体,平衡正向移动.
3.下列说法错误的是( )
| A. | s轨道呈圆形,p轨道呈哑铃形 | |
| B. | Cu元素在元素周期表的ds区 | |
| C. | 1.5g CH3+中含有的电子数为0.8NA | |
| D. | DNA中的碱基互补配对是通过氢键来实现的 |
2.已知R为ⅡA族元素,L为ⅢA族元素,它们的原子序数分别为m和n,且R、L为同一周期元素,下列关系式错误的是( )
| A. | n=m+1 | B. | n=m+10 | C. | n=m+11 | D. | n=m+25 |
1.下列叙述中正确的是( )
0 169280 169288 169294 169298 169304 169306 169310 169316 169318 169324 169330 169334 169336 169340 169346 169348 169354 169358 169360 169364 169366 169370 169372 169374 169375 169376 169378 169379 169380 169382 169384 169388 169390 169394 169396 169400 169406 169408 169414 169418 169420 169424 169430 169436 169438 169444 169448 169450 169456 169460 169466 169474 203614
| A. | 冰融化时水分子中共价键发生断裂 | |
| B. | H2O2、PCl5都是含有极性键的非极性分子 | |
| C. | HF、HCl、HBr、HI的酸性依次增强 | |
| D. | H2O是一种非常稳定的化合物,这是由于氢键所致 |
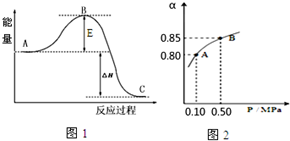 向某10L的恒温密闭容器中充入2molSO2和1molO2,2SO2(g)+O2(g)?2SO3(g)反应过程的能量变化如图1所示.已知1mol SO2(g)氧化为1mol SO3放热99kJ,请回答:
向某10L的恒温密闭容器中充入2molSO2和1molO2,2SO2(g)+O2(g)?2SO3(g)反应过程的能量变化如图1所示.已知1mol SO2(g)氧化为1mol SO3放热99kJ,请回答: