8.在a mL浓度为c mol•L-1的AgNO3溶液中加入一定体积的pH=l的盐酸时,恰好使溶液中的Ag+完全沉淀,此时得到pH=2的溶液100mL (设反应前后溶液体积变化忽略不计),则c的值是( )
| A. | 0.002 0 | B. | 0.011 | C. | 0.11 | D. | 0.22 |
7.已知人体体液中存在如下平衡:H++HCO${\;}_{3}^{-}$?H2CO3?CO2+H2O,以维持体液的pH的相对稳定.下列说法中不合理的是( )
| A. | 当强酸性物质进入体液后,上述平衡向右移动,以维持体液的pH的相对稳定 | |
| B. | 当强碱性物质进入体液后,上述平衡向左移动,以维持体液的pH的相对稳定 | |
| C. | 若静脉滴注大量生理盐水,则体液的pH减小 | |
| D. | 进行呼吸活动时,如CO2进入血液,会使体液的pH减小 |
6.如图是氢氧燃料电池构造示意图.下列说法不正确的是( )
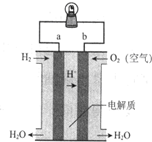

| A. | a极是负极 | B. | 电子由b通过溶液流向a | ||
| C. | 该电池总反应是2H2+O2═H2O | D. | 氢氧燃料电池是环保电池 |
5.短周期元素的四种离子aW3+、bX+、cY2-、dZ-,它们的电子层结构相同,下列关系正确的是( )
| A. | 质子数c>d | B. | 元素的非金属性Y>Z | ||
| C. | 氢化物的稳定性H2Y>HZ | D. | 原子半径X>W |
4.下列关于苯的说法中,不正确的是( )
| A. | 苯不溶于水,可以作为萃取剂将溴从水中分离出来 | |
| B. | 分子中含有三个C-C键和三个C=C键 | |
| C. | 分子中C、H元素的质量比为12:1 | |
| D. | 在空气中燃烧时产生浓烟 |
3.下列实验操作与结论相符的是( )
| A. | 将碘水倒入分液漏斗,加适量乙醇,振荡后静置,可将碘萃取到乙醇中 | |
| B. | 某气体能使湿润的红色石蕊试纸变蓝,该气体水溶液一定显碱性 | |
| C. | 某无色溶液中加Ba(NO3)2溶液,再加稀盐酸,沉淀不溶解,则原溶液中一定有SO42- | |
| D. | 在蔗糖与稀硫酸共热后的溶液中加入新制Cu(OH)2,加热煮沸,会生成砖红色沉淀 |
2.R、W、X、Y、Z五种短周期元素在周期表中的相对位置如图所示,W的气态氢化物可与其最高价含氧酸反应生成离子化合物,由此可知( )
| R | W | |
| X | Y | Z |
| A. | R、W、Y的原子半径依次增大 | |
| B. | R、X、Y的简单氢化物的稳定性依次增强 | |
| C. | W、Y、Z形成的单核阴离子还原性依次增强 | |
| D. | X、Y、Z的最高价氧化物对应水化物的酸性依次增强 |
1.设NA表示阿伏加德罗常数的值,下列说法正确的是( )
| A. | 1 mol苯分子中含有C=C双键数目为3NA | |
| B. | 标准状况下,11.2 L CCl4中含有的共价键数目为2NA | |
| C. | 1 mol乙烯和乙醇的混合物完全燃烧时消耗O2的分子数为3NA | |
| D. | 常温常压下,17 g 羟基含有的电子总数为10NA |
20.恒容恒温条件下,可逆反应H2(g)+I2(g)═2HI(g) 达到平衡的标志是( )
| A. | 混合气体的颜色不再改变 | B. | H2、I2、HI的浓度相等 | ||
| C. | 混合气体的密度保持不变 | D. | H2、I2、HI分子个数比为1:1:2 |
19.下列做法利用了浓度对化学反应速率的影响的是( )
0 169240 169248 169254 169258 169264 169266 169270 169276 169278 169284 169290 169294 169296 169300 169306 169308 169314 169318 169320 169324 169326 169330 169332 169334 169335 169336 169338 169339 169340 169342 169344 169348 169350 169354 169356 169360 169366 169368 169374 169378 169380 169384 169390 169396 169398 169404 169408 169410 169416 169420 169426 169434 203614
| A. | 将食物保存在电冰箱里 | |
| B. | 做粉尘爆炸实验时选用很细的面粉 | |
| C. | 向过氧化氢溶液中加入MnO2 | |
| D. | 铁与稀盐酸反应太慢时加入较浓的盐酸 |