题目内容
5.短周期元素的四种离子aW3+、bX+、cY2-、dZ-,它们的电子层结构相同,下列关系正确的是( )| A. | 质子数c>d | B. | 元素的非金属性Y>Z | ||
| C. | 氢化物的稳定性H2Y>HZ | D. | 原子半径X>W |
分析 短周期元素离子aW3+、bX+、cY2-、dZ-都具有相同的电子层结构,则有a-3=b-1=c+2=d+1,可知原子序数a>b>d>c,Y、Z为非金属,处于第二周期,故Y为O元素,Z为F元素,W、X为金属处于第三周期,W为Al元素,X为Na元素,结合元素周期律解答.
解答 解:短周期元素离子aW3+、bX+、cY2-、dZ-都具有相同的电子层结构,则有a-3=b-1=c+2=d+1,可知原子a>b>d>c,Y、Z为非金属,处于第二周期,故Y为O元素,Z为F元素,W、X为金属处于第三周期,W为Al元素,X为Na元素.
A.由以上分析可知,质子数d>c,故A错误;
B.同周期自左而右非金属性减弱,故非金属性O<F,故B错误;
C.非金属性O<F,氢化物的稳定性H2O<HF,故C错误;
D.同周期自左而右原子半径减小,故原子半径Na>Al,故D正确,
故选D.
点评 本题考查结构与位置关系、元素周期律等,难度中等,根据电荷与核外电子排布相同推断元素在周期表中的位置是关键.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
15.下列关于金属冶炼的说法中,不正确的是( )
| A. | 用热分解法从铁矿石中冶炼金属铁 | |
| B. | 用电解熔融氯化镁的方法获取金属镁 | |
| C. | 金属冶炼的过程是将金属从其化合物中还原出来 | |
| D. | 废旧金属的回收再利用有利于减轻污染、减少能耗 |
16.下列实验结论正确的是( )
| 实验操作 | 现象 | 结论 | |
| A | 食醋浸泡水垢 | 产生无色气体 | 乙酸的氧化性比碳酸强 |
| B | 乙醇与橙色酸性重铬酸钾溶液混合 | 橙色溶液变为绿色 | 乙醇具有还原性 |
| C | 碘酒滴到土豆片上 | 土豆片变蓝 | 淀粉遇化合态碘变蓝 |
| D | 新制Cu(OH)2与葡萄糖溶液混合加热 | 产生红色沉淀 | 葡萄糖具有氧化性 |
| A. | A | B. | B | C. | C | D. | D |
13.250mL K2SO4和CuSO4的混合溶液中c(SO42-)=0.5mol•L-1,用石墨作电极电解此溶液,当通电一段时间后,两极均收集到1.12 L气体(标准状况下).假定电解后溶液体积仍为250mL,下列说法不正确的是( )
| A. | 电解得到Cu的质量为3.2 g | |
| B. | 上述电解过程中共转移电子0.2 mol | |
| C. | 电解后的溶液中c(H+)=0.2 mol•L-1 | |
| D. | 原混合溶液中c(K+)=0.6 mol•L-1 |
20.恒容恒温条件下,可逆反应H2(g)+I2(g)═2HI(g) 达到平衡的标志是( )
| A. | 混合气体的颜色不再改变 | B. | H2、I2、HI的浓度相等 | ||
| C. | 混合气体的密度保持不变 | D. | H2、I2、HI分子个数比为1:1:2 |
10.将CO2持续通入下列八种饱和溶液:①Na2CO3 ②Na2SiO3 ③NaAlO2 ④C6H5ONa ⑤Ca(ClO)2 ⑥CaCl2 ⑦NH3和NaCl ⑧Ca(OH)2,最终能得到沉淀、浊液或析出晶体的是( )
| A. | ②⑤⑧ | B. | ⑤⑥⑧ | C. | ①②③④⑦ | D. | ②③④⑧ |
17.用铁片与稀硫酸反应制氢气时,下列措施能使氢气生成速率加大的是( )
| A. | 降温 | B. | 不用稀硫酸,改用98%浓硫酸 | ||
| C. | 加水稀释硫酸 | D. | 不用铁片,改用铁粉 |
14.下列有关有机物的说法正确的是( )
| A. | 蛋白质溶液与淀粉溶液可用丁达尔效应鉴别 | |
| B. | 麦芽糖与蔗糖的水解产物均含葡萄糖,故二者均为还原型二糖 | |
| C. | 实验室只需用乙酸与乙醇共热就可制得乙酸乙酯 | |
| D. | 将葡萄糖加入新制Cu(OH)2悬浊液中并加热至沸腾,出现红色沉淀 |
15.下列实验装置或操作能达到实验目的是( )
| A. | 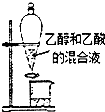 分离乙醇和乙酸 | B. |  制取乙酸乙酯 制取乙酸乙酯 | C. | 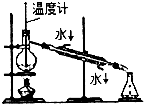 石油的蒸馏 石油的蒸馏 | D. | 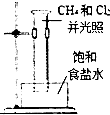 甲烷与氯气反应 |