题目内容
1.设NA表示阿伏加德罗常数的值,下列说法正确的是( )| A. | 1 mol苯分子中含有C=C双键数目为3NA | |
| B. | 标准状况下,11.2 L CCl4中含有的共价键数目为2NA | |
| C. | 1 mol乙烯和乙醇的混合物完全燃烧时消耗O2的分子数为3NA | |
| D. | 常温常压下,17 g 羟基含有的电子总数为10NA |
分析 A、苯不是单双键交替的结构;
B、标况下,四氯化碳为液体;
C、1mol乙烯和1mol乙醇燃烧的耗氧量相等;
D、求出羟基的物质的量,然后根据羟基不显电性来分析.
解答 解:A、苯不是单双键交替的结构,即苯中无碳碳双键,故A错误;
B、标况下,四氯化碳为液体,不能根据气体摩尔体积来计算其物质的量,即11.2L四氯化碳的物质的量不是0.5mol,则含有的共价键无法计算,故B错误;
C、1mol乙烯和1mol乙醇燃烧的耗氧量相等,均为3mol,则1mol乙烯和乙醇的混合物的耗氧量为3mol,即3NA个氧气分子,与两者的比例无关,故C正确;
D、17g羟基的物质的量为1mol,而羟基不显电性,1mol羟基含9mol电子,即9NA个,故D错误.
故选C.
点评 本题考查了阿伏伽德罗常数的有关计算,根据公式和物质的结构来计算是解题关键,难度不大.

练习册系列答案
 智慧小复习系列答案
智慧小复习系列答案
相关题目
11.下列反应中,属于取代反应的是( )
| A. | 乙烯在空气中燃烧 | |
| B. | 乙烯在一定条件下跟HCl反应 | |
| C. | 苯与液溴在FeBr3催化下生成溴苯 | |
| D. | 苯在一定条件下跟H2反应生成环己烷 |
12.下列说法不正确的是( )
| A. | 通过加热分解HgO可制得单质Hg | |
| B. | 铝热法炼铁的还原剂是单质铝 | |
| C. | 高炉炼铁时,是还原剂CO将铁从铁矿石中还原出来 | |
| D. | 蔗糖、果糖和葡萄糖都可以发生水解 |
9.分析如图所示装置,下列叙述不正确的是( )
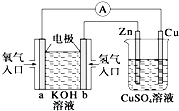

| A. | 左边装置是燃料电池,右边装置是电镀池 | |
| B. | 电子流动方向:b→Zn→CuSO4(aq)→Cu→a | |
| C. | 一段时间后,左端溶液浓度变小,右端溶液浓度不变 | |
| D. | 当锌片的质量变化12.8 g时,a极消耗标准状况下的O2 2.24L |
16.下列说法正确的是( )
| A. | 只含有一种元素的物质一定是纯净物 | |
| B. | 含有共价键的化合物一定是共价化合物 | |
| C. | 石墨转变为金刚石为化学变化 | |
| D. | 水很稳定是因为水分子间存在较强的分子间作用力 |
6.如图是氢氧燃料电池构造示意图.下列说法不正确的是( )
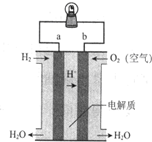

| A. | a极是负极 | B. | 电子由b通过溶液流向a | ||
| C. | 该电池总反应是2H2+O2═H2O | D. | 氢氧燃料电池是环保电池 |
10.设NA为阿伏加德罗常数的数值,下列说法正确的是(H-1,O-16)( )
| A. | 标准状况下,22.4 LCCl4含有的分子数为NA | |
| B. | 常温常压下,18g水含有的分子数为 NA | |
| C. | 常温下,1mol Cl2与过量NaOH溶液反应,转移电子总数为2NA | |
| D. | 1L0.1 mol•L-1 Na2CO3溶液中含有CO32-数为0.1 NA |
11.在一定温度下,向a L密闭容器中加入一定量A、B气体,发生如下反应:A2(g)+3B(g)?2C2 (g)+2D(g),下列叙述能说明该反应达到化学平衡状态的是( )
| A. | 容器中总压强不再随时间而变化 | |
| B. | v正(B)=0.03mol/(L•s),v逆(D)=1.2mol/(L•min) | |
| C. | 单位时间内断裂一个A-A键,同时生成两个C-C键 | |
| D. | 容器中混合气体的密度不再随时间而变化 |
