题目内容
20.恒容恒温条件下,可逆反应H2(g)+I2(g)═2HI(g) 达到平衡的标志是( )| A. | 混合气体的颜色不再改变 | B. | H2、I2、HI的浓度相等 | ||
| C. | 混合气体的密度保持不变 | D. | H2、I2、HI分子个数比为1:1:2 |
分析 可逆反应达到平衡状态时,正逆反应速率相等,反应体系中各物质物质的量、物质的量浓度、百分含量及由此引起的一系列物理量不变,据此分析解答.
解答 解:A.该反应中只有碘有颜色,所以当混合气体的颜色不再改变时,说明碘的物质的量浓度不变,该反应正逆反应速率相等,达到平衡状态,故A正确;
B.H2、I2、HI的浓度相等不一定达到平衡状态,与反应初始浓度及转化率有关,故B错误;
C.反应前后气体质量不变、容器体积不变,所以密度始终不变,所以不能根据密度判断是否达到平衡状态,故C错误;
D.H2、I2、HI分子个数比为1:1:2不一定达到平衡状态,与反应初始浓度及转化率有关,故D错误;
故选A.
点评 本题考查化学平衡状态的判断,明确平衡状态特征是解本题关键,注意:只有反应前后改变的物理量才能作为平衡状态判断标准,易错选项是C,注意该反应方程式特点.

练习册系列答案
相关题目
10.下列物质中,与CH3-CH=CH-CH3互为同分异构体的是( )
| A. | CH3CH2CH2CH3 | B. | 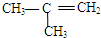 | C. | 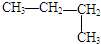 | D. | CH3-CH=CH2 |
11.甲、乙、丙、丁都是短周期元素,其中甲、丁在周期表中的相对位置如下表,甲原子最外层电子数是其内层电子数的2倍,乙单质在空气中燃烧发出黄色火焰,丙是地壳中含量最高的金属元素.下列判断正确的是( )
| 甲 | ||
| 丁 |
| A. | 简单离子半径:乙>丁 | |
| B. | 乙与氧元素形成的某化合物中可能既有离子键,又有共价键 | |
| C. | 乙、丙、丁三种元素最高价氧化物的水化物两两之间能发生反应 | |
| D. | 甲与丁的核外电子数相差8 |
8.根据有机物的系统命名法,下列命名正确的是( )
| A. | CH3CH(C2H5)CH2CH2CH3 2-乙基戊烷 | |
| B. | CH2=CH(CH3)C=CH2 2-甲基-1,3-二丁烯 | |
| C. | CH2(OH)CH2CH2CH2OH 1,4-二羟基丁醇 | |
| D. | CH3CH2CHClCCl2CH3 2,2,3-三氯戊烷 |
15.下列化学用语表达正确的是( )
| A. | 氮气的电子式 | B. | 乙烯的结构简式 CH2CH2 | ||
| C. | 次氯酸的电子式 | D. | 苯分子的比例模型  |
5.短周期元素的四种离子aW3+、bX+、cY2-、dZ-,它们的电子层结构相同,下列关系正确的是( )
| A. | 质子数c>d | B. | 元素的非金属性Y>Z | ||
| C. | 氢化物的稳定性H2Y>HZ | D. | 原子半径X>W |
12.分子式为C5H12O的醇与某一元羧酸发生酯化反应,该醇与该羧酸的相对分子质量相同.不考虑立体异构,其反应生成的酯共有( )
| A. | 15种 | B. | 16种 | C. | 17种 | D. | 18种 |
9.下列各组离子在溶液中能够大量共存的是( )
| A. | NH4+、Ca2+、OH-、HCO3- | B. | Ag+、H+、SO32-、ClO- | ||
| C. | NH4+、Br-、Na+、SO42- | D. | H+、Cl-、Fe2+、NO3- |
10.下列分子式所表示的物质的同分异构体数目最多的是(不考虑立体异构)( )
| A. | CH2Cl2 | B. | C2H2Cl2 | C. | C4H8 | D. | C3H7Cl |