题目内容
2.R、W、X、Y、Z五种短周期元素在周期表中的相对位置如图所示,W的气态氢化物可与其最高价含氧酸反应生成离子化合物,由此可知( )| R | W | |
| X | Y | Z |
| A. | R、W、Y的原子半径依次增大 | |
| B. | R、X、Y的简单氢化物的稳定性依次增强 | |
| C. | W、Y、Z形成的单核阴离子还原性依次增强 | |
| D. | X、Y、Z的最高价氧化物对应水化物的酸性依次增强 |
分析 由R、W、X、Y、Z四种短周期元素在元素周期表中的相对位置,可知R、W处于第二周期,X、Y、Z处于第三周期,W的气态氢化物可与其最高价含氧酸反应生成离子化合物,则W为N元素,可推知R为C元素、X为Si元素,Y为P元素,Z为S.
A.同周期自左而右原子半径减小、电子层越多原子半径越大;
B.元素非金属性越强,对应氢化物越稳定;
C.元素非金属性越强,形成阴离子的还原性越弱;
D.元素非金属性越强,最高价含氧酸的酸性越强.
解答 解:由R、W、X、Y、Z四种短周期元素在元素周期表中的相对位置,可知R、W处于第二周期,X、Y、Z处于第三周期,W的气态氢化物可与其最高价含氧酸反应生成离子化合物,则W为N元素,可推知R为C元素、X为Si元素,Y为P元素,Z为S.
A.同周期自左而右原子半径减小、电子层越多原子半径越大,故原子半径:W<R<Y,故A错误;
B.非金属性R>X,Y>X,非金属性越强,氢化物越稳定,故X的氢化物稳定性最弱,故B错误;
C.非金属性N>P,S>P,故P元素形成阴离子还原性最强,故C错误;
D.非金属性S>P>Si,故酸性硅酸<磷酸<硫酸,故D正确,
故选:D.
点评 本题考查结构性质位置关系应用,侧重对元素周期律的考查,推断元素是解题关键,注意对元素周期律的理解掌握.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
12.下列关于Na元素的叙述中,不正确的是( )
| A. | Na原子最外层有1个电子 | B. | Na单质能跟水反应放出氢气 | ||
| C. | Na原子比Mg原子更易失去电子 | D. | Na与氧气在加热条件下生成氧化钠 |
13.某有机物的结构简式为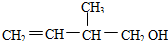 下列的叙述错误的是( )
下列的叙述错误的是( )
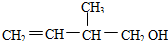 下列的叙述错误的是( )
下列的叙述错误的是( )| A. | 此有机物的官能团是羟基和碳碳双键 | |
| B. | 能在催化剂条件下与H2发生加成反应 | |
| C. | 此有机物不能发生加聚反应 | |
| D. | 在浓H2SO4催化下能与乙酸发生酯化反应 |
10.对下列各组反应所属类型的判断和书写均正确的是( )
| A. | CaC2与水反应制乙炔,乙烯与水反应制乙醇--水解反应 | |
| B. | 由苯制硝基苯,由甲苯制TNT--消化反应 | |
| C. | 油脂的硬化,油脂的氢化--加聚反应 | |
| D. | 乙醇与酸性K2Cr2O7溶液反应,乙醛与新制Cu(OH)2浊液反应--氧化反应 |
17.下列反应中,属于取代反应的是( )
| A. | CH3CH3+Br2$\stackrel{光照}{→}$ CH3CH2Br+HBr | B. | CH2=CH2+HBr-→CH3CH2Br | ||
| C. | 2C2H2+5O2$\stackrel{点燃}{→}$ 4CO2+2H2O | D. | C4H10$\stackrel{高温}{→}$ C2H4+C2H6 |
7.已知人体体液中存在如下平衡:H++HCO${\;}_{3}^{-}$?H2CO3?CO2+H2O,以维持体液的pH的相对稳定.下列说法中不合理的是( )
| A. | 当强酸性物质进入体液后,上述平衡向右移动,以维持体液的pH的相对稳定 | |
| B. | 当强碱性物质进入体液后,上述平衡向左移动,以维持体液的pH的相对稳定 | |
| C. | 若静脉滴注大量生理盐水,则体液的pH减小 | |
| D. | 进行呼吸活动时,如CO2进入血液,会使体液的pH减小 |
11.下列实验方案设计中,不能达到实验目的是( )
| 选项 | 实验目的 | 实验方案 |
| A | 检验FeCl2溶液中的FeCl2是否被氧化 | 向该溶液中滴加硫氰化钾溶液 |
| B | 证明H2CO3酸性比H2SiO3强 | Na2CO3和SiO2在高温下熔融反应 |
| C | 除去Cu粉中混有的CuO | 向混合物中滴加适量稀硫酸 |
| D | 证明CH2=CHCHO中含有醛基 | 向新制银氨溶液中滴少量丙烯醛并用水浴加热 |
| A. | A | B. | B | C. | C | D. | D |
12.某锂电池的电池总反应为4Li+2SOCl2═4LiCl+S+SO2,下列有关说法错误的是( )
| A. | 锂电极作电池负极,放电过程中发生氧化反应 | |
| B. | 1molSOCl2发生电极反应转移的电子数为2mol | |
| C. | 电池的正极反应为2SOCl2+2e-═4Cl-+S+SO2 | |
| D. | 组装该电池必须在无水、无氧的条件下进行 |