5.冬青油是一种无色液体,某实验小组利用如图1所示的装置制备冬青油.化学反应原理和实验装置如图2所示:

产物的有关数据如表所示:
实验步骤如下所示:
①向三颈瓶中加入6.9g(0.05mol)水杨酸和24g(0.75mol)甲醇,再小心地加入6mL浓硫酸,摇匀.
②加入2粒沸石(或碎瓷片),装上仪器a,在石棉网上保持温度在85~95℃,回流1.5h.
③反应完毕,将烧瓶冷却,加入50mL蒸馏水,然后转移至分液漏斗,弃去水层,将有机层再倒入分液漏斗中,依次用50mL 5%碳酸氢钠溶液和30mL水洗涤.
④将产物移至干燥的锥形瓶中,加入0.5g无水氯化钙.
⑤最后将粗产品进行蒸馏,收集221~224℃的馏分,其质量为6.8g.
请回答下列问题:
(1)本实验中浓硫酸的作用是催化剂、吸水剂.
(2)装置中仪器a的名称是冷凝管,进水口为Ⅱ(填“Ⅰ”或“Ⅱ”).
(3)②中的沸石的作用防止瀑沸,实验过程中发现未加沸石,因采取的操作是B(写序号)
A.立即补加 B.冷却后补加 C.不需补加 D.重新配料
(4)用碳酸氢钠溶液洗涤的目的是将冬青油中的甲醇、水杨酸溶解,便于液体分层;用水洗涤时,产品在下(填“上”或“下”)层.
(5)加入无水氯化钙的目的是除去粗产品中的水分.
(6)粗产品蒸馏过程中,不可能用到图3中的仪器有B.(填正确答案序号)
(7)本次实验中冬青油的产率为89.5%.

产物的有关数据如表所示:
| 相对分 子质量 | 密度/g•cm-3 | 沸点/℃ | 溶解性 | |
| 冬青油 | 152 | 1.180 | 222.2 | 微溶于水 |
①向三颈瓶中加入6.9g(0.05mol)水杨酸和24g(0.75mol)甲醇,再小心地加入6mL浓硫酸,摇匀.
②加入2粒沸石(或碎瓷片),装上仪器a,在石棉网上保持温度在85~95℃,回流1.5h.
③反应完毕,将烧瓶冷却,加入50mL蒸馏水,然后转移至分液漏斗,弃去水层,将有机层再倒入分液漏斗中,依次用50mL 5%碳酸氢钠溶液和30mL水洗涤.
④将产物移至干燥的锥形瓶中,加入0.5g无水氯化钙.
⑤最后将粗产品进行蒸馏,收集221~224℃的馏分,其质量为6.8g.
请回答下列问题:
(1)本实验中浓硫酸的作用是催化剂、吸水剂.
(2)装置中仪器a的名称是冷凝管,进水口为Ⅱ(填“Ⅰ”或“Ⅱ”).
(3)②中的沸石的作用防止瀑沸,实验过程中发现未加沸石,因采取的操作是B(写序号)
A.立即补加 B.冷却后补加 C.不需补加 D.重新配料
(4)用碳酸氢钠溶液洗涤的目的是将冬青油中的甲醇、水杨酸溶解,便于液体分层;用水洗涤时,产品在下(填“上”或“下”)层.
(5)加入无水氯化钙的目的是除去粗产品中的水分.
(6)粗产品蒸馏过程中,不可能用到图3中的仪器有B.(填正确答案序号)
(7)本次实验中冬青油的产率为89.5%.
2.现有下列十种物质:①H2;②铜;③CaO;④CO2;⑤H2SO4;⑥Ba(OH)2;
⑦红褐色的氢氧化铁液体; ⑧氨水;⑨稀硝酸;⑩Al2(SO4)3
上述各物质按物质的分类方法填写表格的空白处(填物质编号):
(2)上述十种物质中有两种物质之间可发生离子反应:H++OH-=H2O,该离子反应对应的化学方程式为Ba(OH)2+2HNO3=Ba(NO3)2+2H2O
(3)⑩在水中的电离方程式为Al2(SO4)3=2Al3++3SO42-.
(4)少量的④通入⑥的溶液中反应的离子方程式为Ba2++2OH-+CO2=BaCO3↓+H2O.
(5)②与⑨发生反应的化学方程式为:3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O,该反应的氧化剂是HNO3(填化学式),氧化剂与还原剂的物质的量之比是2:3,当有3.2g Cu发生反应时,转移电子的物质的量为0.1mol.该反应的离子方程式为3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O.
⑦红褐色的氢氧化铁液体; ⑧氨水;⑨稀硝酸;⑩Al2(SO4)3
上述各物质按物质的分类方法填写表格的空白处(填物质编号):
| 分类标准 | 金属单质 | 酸性氧化物 | 碱性氧化物 | 溶液 | 胶体 | 电解质 |
| 属于该类的物质 |
(3)⑩在水中的电离方程式为Al2(SO4)3=2Al3++3SO42-.
(4)少量的④通入⑥的溶液中反应的离子方程式为Ba2++2OH-+CO2=BaCO3↓+H2O.
(5)②与⑨发生反应的化学方程式为:3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O,该反应的氧化剂是HNO3(填化学式),氧化剂与还原剂的物质的量之比是2:3,当有3.2g Cu发生反应时,转移电子的物质的量为0.1mol.该反应的离子方程式为3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O.
6.对于2(g)A+B(g)?2C(g),△H<0,当温度升高时,平衡向逆反应方向移动,其原因是( )
| A. | 正反应速率增大,逆反应速率减小 | |
| B. | 逆反应速率增大,正反应速率减小 | |
| C. | 正、逆反应速率均增大,但是逆反应速率增大的程度大于正反应速率增大的程度 | |
| D. | 正、逆反应速率均增大,而且增大的程度一样 |
5.下列说法错误的是( )
| A. | 84g NaHCO3 溶于1L水配得1mol•L-1 NaHCO3 溶液 | |
| B. | 在标准状况下,44.8L HCl溶于1L水配成2mol•L-1 的盐酸溶液 | |
| C. | 在标准状况下,22.4L NH3溶于水配成1L溶液,浓度为1mol•L-1 | |
| D. | 1mol•L-1 的CaCl2溶液溶液1L,取出100mL,含0.2mol Cl- |
4.16mL由NO与NH3组成的混合气体在催化剂作用下于400℃左右可发生反应:6NO+4NH3?5N2+6H2O(g),达到平衡时在相同条件下气体体积变为17.5mL,则原混合气体中NO与NH3的物质的量之比有四种情况:①5:3;②3:2;③4:3;④9:7.其中正确的是( )
0 169139 169147 169153 169157 169163 169165 169169 169175 169177 169183 169189 169193 169195 169199 169205 169207 169213 169217 169219 169223 169225 169229 169231 169233 169234 169235 169237 169238 169239 169241 169243 169247 169249 169253 169255 169259 169265 169267 169273 169277 169279 169283 169289 169295 169297 169303 169307 169309 169315 169319 169325 169333 203614
| A. | ①② | B. | ①④ | C. | ②③ | D. | ③④ |
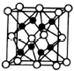 X、Y、Z、R、W均为周期表中前四周期的元素,其原子序数依次增大,其中只有W为第四周期元素.X与Y基态原子的成对电子数之比为2:3,未成对电子数之比为1:1,Z是元素周期表中s区元素,但有未成对电子,R的氢化物的沸点比其上周期同族元素氢化物的沸点低,W为金属元素,Y与W形成的某种化合物与R的氢化物的浓溶液加热时反应可用于实验室制取R的气态单质,回答下列问题:
X、Y、Z、R、W均为周期表中前四周期的元素,其原子序数依次增大,其中只有W为第四周期元素.X与Y基态原子的成对电子数之比为2:3,未成对电子数之比为1:1,Z是元素周期表中s区元素,但有未成对电子,R的氢化物的沸点比其上周期同族元素氢化物的沸点低,W为金属元素,Y与W形成的某种化合物与R的氢化物的浓溶液加热时反应可用于实验室制取R的气态单质,回答下列问题: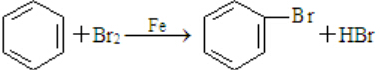 ;
; .
. .
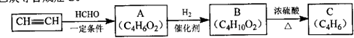
.
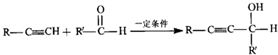
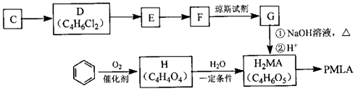
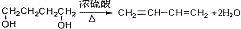 ,其反应类型是消去反应.
,其反应类型是消去反应. .
.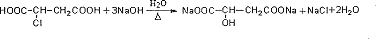 .
.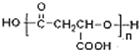 .
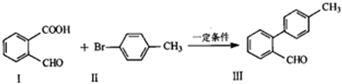
.
 .
.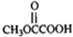 与
与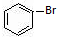 也可以发生类似反应①的反应,有机产物的结构简式为:
也可以发生类似反应①的反应,有机产物的结构简式为: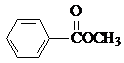 .
.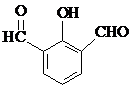 、
、 、
、