10.天然纤维是自然界原有的或经人工培植的植物上、人工饲养的动物上直接取得的纺织纤维.化学纤维指用天然的或合成的聚合物为原料,经化学方法制成的纤维.下列物质属于天然纤维且其主要成份是纤维素的是( )
| A. | 光导纤维 | B. | 人造丝 | C. | 棉花 | D. | 蚕丝 |
6.I.有X、Y、Z、R四种短周期元素,Y、Z、R同周期.相关信息如下:
(1)Z元素在周期表的位置是第三周期第ⅦA族,Y、Z、R简单离子的半径从大到小的顺序是S2->Cl->Na+(用离子符号表示)
(2)由X、Z两种元素组成的化合物甲,常温下为易挥发的淡黄色液体,甲分子构型为三角锥形,且分子里X、Z两种原子最外层均达到8个电子的稳定结构.甲遇水蒸气可形成一种常见的漂白性物质.则甲的结构式为
(3)化合物乙(Y2R)溶液在空气中长期放置,与氧气反应会生成与过氧化钠的结构和化学性质相似的物质Y2R2,其溶液显黄色.则Y2R2的电子式为 ,写出乙溶液在空气中变质过程的化学方程式4Na2S+O2+2H2O═4NaOH+2Na2S2
,写出乙溶液在空气中变质过程的化学方程式4Na2S+O2+2H2O═4NaOH+2Na2S2
II.元素X与氢可形成多种化合物,如丙、丁、戊.
(4)丙为一元弱酸,对热稳定但受撞击就爆炸.8.6g丙爆炸分解生成0.1molH2和6.72L(标况下)X2.写出其爆炸的化学方程式2HN3=3N2+H2
(5)丁为离子化合物,遇水反应生成H2和气体戊,标况下戊的密度为0.76g•L-1,则物质丁的化学式为NH4H.
| 相关信息 | |
| X | 单质为双原子分子.若低温蒸发液态空气,因其沸点较低可先获得X的单质, 该单质常温下化学性质很稳定. |
| Y | 含Y元素的物质焰色反应为黄色 |
| Z | 同周期元素中原子半径最小 |
| R | R元素原子的最外层电子数是K层电子数的3倍 |
(2)由X、Z两种元素组成的化合物甲,常温下为易挥发的淡黄色液体,甲分子构型为三角锥形,且分子里X、Z两种原子最外层均达到8个电子的稳定结构.甲遇水蒸气可形成一种常见的漂白性物质.则甲的结构式为

(3)化合物乙(Y2R)溶液在空气中长期放置,与氧气反应会生成与过氧化钠的结构和化学性质相似的物质Y2R2,其溶液显黄色.则Y2R2的电子式为
 ,写出乙溶液在空气中变质过程的化学方程式4Na2S+O2+2H2O═4NaOH+2Na2S2
,写出乙溶液在空气中变质过程的化学方程式4Na2S+O2+2H2O═4NaOH+2Na2S2II.元素X与氢可形成多种化合物,如丙、丁、戊.
(4)丙为一元弱酸,对热稳定但受撞击就爆炸.8.6g丙爆炸分解生成0.1molH2和6.72L(标况下)X2.写出其爆炸的化学方程式2HN3=3N2+H2
(5)丁为离子化合物,遇水反应生成H2和气体戊,标况下戊的密度为0.76g•L-1,则物质丁的化学式为NH4H.
5.将等质量的铜片在酒精灯上加热后,分别插入溶液中,放置片刻铜片质量减小的是( )
| A. | 水 | B. | 无水乙醇 | C. | 石灰水 | D. | 盐酸 |
4. 为实现2008北京“科技奥运”战略,我国兴奋剂检测生物芯片装置已定型和批量生产,可快捷检测常见的16种兴奋剂.已知某兴奋剂乙基雌烯醇(etylestrenol)的结构如右图所示.下列叙述中正确的是( )
为实现2008北京“科技奥运”战略,我国兴奋剂检测生物芯片装置已定型和批量生产,可快捷检测常见的16种兴奋剂.已知某兴奋剂乙基雌烯醇(etylestrenol)的结构如右图所示.下列叙述中正确的是( )
 为实现2008北京“科技奥运”战略,我国兴奋剂检测生物芯片装置已定型和批量生产,可快捷检测常见的16种兴奋剂.已知某兴奋剂乙基雌烯醇(etylestrenol)的结构如右图所示.下列叙述中正确的是( )
为实现2008北京“科技奥运”战略,我国兴奋剂检测生物芯片装置已定型和批量生产,可快捷检测常见的16种兴奋剂.已知某兴奋剂乙基雌烯醇(etylestrenol)的结构如右图所示.下列叙述中正确的是( )| A. | 该物质可以视为烃类 | B. | 该有机物的分子式为C20H32O | ||
| C. | 不能使溴的四氯化碳溶液褪色 | D. | 该物质分子中的所有碳原子均共面 |
3.下列表述正确的是( )
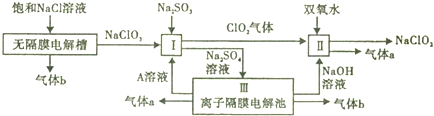
| A. | 2-丁烯的结构式CH3CH=CHCH3 | B. | 聚丙烯的结构简式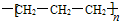 | ||
| C. | 四氯化碳分子的电子式 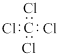 | D. | 丙烷分子的球棍模型 |
1.
 实验室用乙酸和正丁醇制备乙酸正丁醇,有关物质的相关数据如下表:
实验室用乙酸和正丁醇制备乙酸正丁醇,有关物质的相关数据如下表:
(一)乙酸正丁酯的制备
①在干燥的50mL三颈烧瓶中,加入13.5mL正丁醇和7.2mL冰醋酸,再加3~4滴浓硫酸,摇匀,然后安装分水器投入1~2粒沸石.然后安装分水器(作用:实验过程中不断分离除去反应生成的水),温度计及回流冷凝管,加热冷凝回流反应.
(二)产品的精制
②将分水器分出的酯层和反应液一起倒入分液漏斗中,用10mL水洗涤,有机层继续用10mL 10% Na2CO3溶液洗涤至中性,再用10mL水洗涤,最后将有机层转移至锥形瓶中,再用无水硫酸镁干燥.
③将干燥后的乙酸正丁酯注入50mL烧瓶中,常压蒸馏,收集125~127°C的馏分,得11.6g乙酸正丁酯.
请回答有关问题:
(1)冷水应该从冷凝管a(填a或b)管口通入;
(2)写出该制备反应的化学方程式:CH3COOH+CH3CH2CH2CH2OH$→_{△}^{浓硫酸}$CH3COOCH2CH2CH2CH3+H2O;
(3)步骤①中不断从分水器下部分出生成的水的目的是使平衡正向移动,提高反应产率;
(4)产品的精制过程步骤②中,第一次水洗的目的是除去乙酸及少量的正丁醇,用饱和Na2C03溶液洗涤有机层,该步操作的目的是除去产品中含有的乙酸等杂质;
(5)下列关于分液漏斗的使用叙述正确的是D(填字母);
A.分液漏斗使用前必须要检漏,只要分液漏斗的旋塞芯处不漏水即可使用
B.装液时,分液漏斗中液体的总体积不得超过其容积的$\frac{2}{3}$
C.萃取振荡操作应如图所示
D.放出液体时,需将玻璃塞打开或使塞上的凹槽对准漏斗口上的小孔
(6)该实验过程中,生成乙酸正丁酯(相对分子质量为116)的产率是80%.
0 169058 169066 169072 169076 169082 169084 169088 169094 169096 169102 169108 169112 169114 169118 169124 169126 169132 169136 169138 169142 169144 169148 169150 169152 169153 169154 169156 169157 169158 169160 169162 169166 169168 169172 169174 169178 169184 169186 169192 169196 169198 169202 169208 169214 169216 169222 169226 169228 169234 169238 169244 169252 203614

 实验室用乙酸和正丁醇制备乙酸正丁醇,有关物质的相关数据如下表:
实验室用乙酸和正丁醇制备乙酸正丁醇,有关物质的相关数据如下表:| 化合物 | 相对分子质量 | 密度/g•cm-3 | 沸点/℃ | 溶解度/(g/100g水) |
| 正丁醇 | 74 | 0.80 | 118.0 | 9 |
| 冰醋酸 | 60 | 1.045 | 118.1 | 互溶 |
| 乙酸正丁酯 | 116 | 0.882 | 126.1 | 0.7 |
①在干燥的50mL三颈烧瓶中,加入13.5mL正丁醇和7.2mL冰醋酸,再加3~4滴浓硫酸,摇匀,然后安装分水器投入1~2粒沸石.然后安装分水器(作用:实验过程中不断分离除去反应生成的水),温度计及回流冷凝管,加热冷凝回流反应.
(二)产品的精制
②将分水器分出的酯层和反应液一起倒入分液漏斗中,用10mL水洗涤,有机层继续用10mL 10% Na2CO3溶液洗涤至中性,再用10mL水洗涤,最后将有机层转移至锥形瓶中,再用无水硫酸镁干燥.
③将干燥后的乙酸正丁酯注入50mL烧瓶中,常压蒸馏,收集125~127°C的馏分,得11.6g乙酸正丁酯.
请回答有关问题:
(1)冷水应该从冷凝管a(填a或b)管口通入;
(2)写出该制备反应的化学方程式:CH3COOH+CH3CH2CH2CH2OH$→_{△}^{浓硫酸}$CH3COOCH2CH2CH2CH3+H2O;
(3)步骤①中不断从分水器下部分出生成的水的目的是使平衡正向移动,提高反应产率;
(4)产品的精制过程步骤②中,第一次水洗的目的是除去乙酸及少量的正丁醇,用饱和Na2C03溶液洗涤有机层,该步操作的目的是除去产品中含有的乙酸等杂质;
(5)下列关于分液漏斗的使用叙述正确的是D(填字母);
A.分液漏斗使用前必须要检漏,只要分液漏斗的旋塞芯处不漏水即可使用
B.装液时,分液漏斗中液体的总体积不得超过其容积的$\frac{2}{3}$
C.萃取振荡操作应如图所示
D.放出液体时,需将玻璃塞打开或使塞上的凹槽对准漏斗口上的小孔
(6)该实验过程中,生成乙酸正丁酯(相对分子质量为116)的产率是80%.
 ,沸点196.5℃.请回答下列问题:
,沸点196.5℃.请回答下列问题: 的沸点>196.5℃.(填“>”、“<”或“=”)原因是
的沸点>196.5℃.(填“>”、“<”或“=”)原因是 .
.