题目内容
8.已知由短周期元素组成的A、B、C、D、E五种化合物,它们所含原子数目依次为2、3、4、5、6,其中A、B、C、E含有18个电子,D含有10个电子.请回答:(1)A的化学式是:HCl,用电子式表示B的形成过程
 .
.(2)若C为第一和第三周期元素组成的化合物,C在空气中能够自燃生成两种常见的氧化物,化学方程式是2PH3+402$\frac{\underline{\;点燃\;}}{\;}$P205+3H20.
(3)若C为第一和第二周期元素组成的化合物,在C的溶液中加入少量二氧化锰,有无色气体生成,则C分子中化学键的类型有极性键、非极性键.
分析 由短周期两原子组成的18电子的化合物为HCl,三原子组成的18电子的化合物为H2S,四原子组成的18电子化合物为PH3或H2O2,4个原子组成的18电子化合物为C2H4,由短周期五原子组成的10电子的化合物为CH4,由此分析解答.
解答 解:(1)A为氯化氢,化学式为:HCl;三原子组成的18电子的化合物为H2S,H2S为共价化合物,分子中存在两个H-S键,用电子式表示其形成过程为: ;故答案为:HCl;
;故答案为:HCl; ;
;
(2)若C为第一和第三周期元素组成的化合物,所以C为磷化氢,燃烧的化学方程式为:2PH3+402$\frac{\underline{\;点燃\;}}{\;}$P205+3H20,故答案为:2PH3+402$\frac{\underline{\;点燃\;}}{\;}$P205+3H20;
(3)若C为第一和第二周期元素组成的化合物,则C是过氧化氢,化学键的类型是氢氧极性键、氧氧非极性键,故答案为:极性键、非极性键.
点评 本题考查原子结构与元素周期律知识,难度中等,解题关键是掌握前20号元素原子结构及1电子、18电子微粒.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
6.下列变化过程中,同时有离子键、极性键、非极性键的断裂和形成的是( )
| A. | 2NH4HCO3=2NH3+CO2+2H2O | B. | 2NaOH+Cl2=NaCl+NaClO+H2O | ||
| C. | 2Na2O2+2CO2=2Na2CO3+O2 | D. | H2+Cl2=2HCl |
7.下述情况下物质的量可能不相等的是( )
| A. | 密度相等,等体积的NO和 C2H6 (g) | B. | 常温常压下,等体积的NO和 C2H6 (g) | ||
| C. | 等温条件下,等体积的NO和 C2H6 (g) | D. | 常温常压下,等质量的NO和 C2H6 (g) |
4.下列关于NH4Cl的说法中不正确的是( )
| A. | 氨气遇到HCl时,可以迅速反应生成NH4Cl | |
| B. | 0.5molNH4Cl中含有氢原子的质量是2克 | |
| C. | NH4Cl易溶于水,很稳定,受热不会分解 | |
| D. | 加热NH4Cl和碱的混合物,可以制取到氨气 |
3.下列表述正确的是( )
| A. | 2-丁烯的结构式CH3CH=CHCH3 | B. | 聚丙烯的结构简式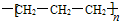 | ||
| C. | 四氯化碳分子的电子式 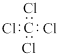 | D. | 丙烷分子的球棍模型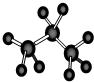 |
13.下列除去杂质的方法中正确的是( )
| A. | 苯甲醛中混有苯甲酸,加入生石灰,再加热蒸馏 | |
| B. | 乙醇中混有乙酸,加入NaOH溶液后,用分液漏斗分液 | |
| C. | 乙烷中混有乙烯,加入氢气在一定条件下充分反应 | |
| D. | 溴苯中混有溴,加入KI溶液后,用分液漏斗分液 |
20.下列物质中既有离子键又有共价键的可溶性化合物是( )
| A. | H2SO4 | B. | BaSO4 | C. | N2 | D. | NaOH |