题目内容
2.亚氯酸钠(NaClO2)是一种强氧化性漂白剂,广泛用于纺织、印染和食品工业.它在碱性环境中稳定存在.某同学查阅资料后设计生产NaClO2的主要流程如下.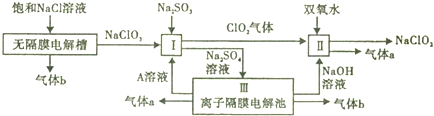
(1)Ⅱ中反应的离子方程式是2ClO2+H2O2+2OH-=2ClO2-+O2↑+2H2O.
(2)A的化学式是H2SO4,装置Ⅲ中A在阳极区产生.
(3)ClO2是种高效水处理剂,可用亚氯酸钠和稀盐酸为原料制备.写出该制备反应的化学方程式5NaClO2+4HCl=5NaCl+4ClO2↑+2H2O.
(4)工业以CH3OH与NaClO2为原料在酸性条件下制取ClO2,同时产生CO2气体,已知该反应分为两步进行,第一步为2ClO2-+2Cl-+4H+=2ClO2↑+Cl2↑+2H2O.
①写出第二步反应的离子方程式CH3OH+3Cl2+H2O=6Cl-+CO2+6H+.
②工业生产时需在反应物中加少量Cl-,其作用是催化剂.
③生产中会发生副反应ClO2-+Cl-+H+=Cl2↑+H2O(未配平),若测得反应后的混合气体中Cl2的体积分数为$\frac{3}{52}$,测起始投料时CH3OH与NaClO2的物质的量之比为7:43.
分析 由流程图可知,电解饱和氯化钠反应得到NaClO3,气体b为还原产物为H2,I中NaClO3、Na2SO3、加入A溶液,反应生成Na2SO4、C1O2,反应离子方程式为2H++SO32-+2ClO3-=2C1O2+SO42-+H2O,Ⅲ是离子隔膜电解池,反应有酸、碱及有两种气体生成,所以Ⅲ为电解硫酸钠本质是电解水,A为硫酸,a为氧气,C1O2与过氧化氢在碱性条件下反应生成NaClO2和氧气.
(1)C1O2与过氧化氢在碱性条件下反应生成NaClO2和氧气,配平书写离子方程式;
(2)水放电生成氧气与氢离子,发生氧化反应,硫酸在阳极生成;
(3)亚氯酸钠和稀盐酸反应生成ClO2、NaCl与水;
(4)①由题目信息可知,氯气为中间产物,第二步是氯气与甲醇反应生成二氧化碳与HCl,发生反应:CH3OH+3Cl2+H2O=6Cl-+CO2+6H+;
②Cl-参与反应但反应前后没有变化,故为催化剂,起催化作用;
③发生反应为:I.CH3OH+6ClO3-+6H+=CO2↑+6ClO2↑+5H2O、Ⅱ.ClO3-+5Cl-+6H+=3Cl2↑+3H2O,假设反应后混合气体的物质的量为52mol,则n(Cl2)=3mol,由反应I可得混合气体中n(ClO2)=6n(CO2),进而计算各自物质的量,结合方程式计算.
解答 解:由流程图可知,电解饱和氯化钠反应得到NaClO3,气体b为还原产物为H2,I中NaClO3、Na2SO3、加入A溶液,反应生成Na2SO4、C1O2,反应离子方程式为2H++SO32-+2ClO3-=2C1O2+SO42-+H2O,Ⅲ是离子隔膜电解池,反应有酸、碱及有两种气体生成,所以Ⅲ为电解硫酸钠本质是电解水,A为硫酸,a为氧气,C1O2与过氧化氢在碱性条件下反应生成NaClO2和氧气.
(1)C1O2与过氧化氢在碱性条件下反应生成NaClO2和氧气,离子方程式为:2ClO2+H2O2+2OH-=2ClO2-+O2↑+2H2O,
故答案为:2ClO2+H2O2+2OH-=2ClO2-+O2↑+2H2O;
(2)由上述分析可知,A为H2SO4,水放电生成氧气与氢离子,发生氧化反应,硫酸在阳极生成,
故答案为:H2SO4;阳;
(3)亚氯酸钠和稀盐酸反应生成ClO2、NaCl与水,反应方程式为:5NaClO2+4HCl=5NaCl+4ClO2↑+2H2O,
故答案为:5NaClO2+4HCl=5NaCl+4ClO2↑+2H2O;
(4)①由题目信息可知,氯气为中间产物,第二步是氯气与甲醇反应生成二氧化碳与HCl,发生反应:CH3OH+3Cl2+H2O=6Cl-+CO2+6H+,
故答案为:CH3OH+3Cl2+H2O=6Cl-+CO2+6H+;
②Cl-参与反应但反应前后没有变化,故为催化剂,起催化作用,
故答案为:催化剂;
③发生的反应方程式为:
Ⅰ.CH3OH+6ClO3-+6H+=CO2↑+6ClO2↑+5H2O
Ⅱ.ClO3-+5Cl-+6H+=3Cl2↑+3H2O
假设反应后混合气体的物质的量为52mol,则n(Cl2)=3mol,
由反应Ⅰ可得混合气体中n(ClO2)=6n(CO2),则n(CO2)=(52mol-3mol)×$\frac{1}{7}$=7mol,n(ClO2)=7mol×6=42mol,则n(CH3OH)=n(CO2)=7mol,反应I中n(ClO3-)=42mol,
由反应Ⅱ,可知得该反应的n(ClO3-)=1mol,
所以n(CH3OH):n(ClO3-)=7mol:(42+1)nol=7:43,
故答案为:7:43.
点评 本题考查物质制备实验方案,明确化学工艺流程是解题关键,涉及电解原理、氧化还原反应方程式的书写、计算等内容,侧重于学生的分析能力、实验能力和计算能力的考查,题目难度中等.

 阅读快车系列答案
阅读快车系列答案| A. | 阳极上产生能够使湿润淀粉碘化钾试纸变蓝的气体 | |
| B. | 电解一段时间后,电解池的温度升高10℃,此时铁片上析出气体的速率加快 | |
| C. | 电解时钠离子向铜片电极方向移动 | |
| D. | 电解一段时间后溶液中会出现蓝色沉淀,总反应为:Cu+2H2O$\frac{\underline{\;通电\;}}{\;}$Cu(OH)2↓+H2↑ |
 如图是两个反应反应前后反应物总能量和生成物总能量的比较图,对于A、B两个反应的说法正确的是( )
如图是两个反应反应前后反应物总能量和生成物总能量的比较图,对于A、B两个反应的说法正确的是( )| A. | A反应必须加热,B反应不需要加热 | |
| B. | A反应是放热反应,B反应是吸热反应 | |
| C. | A反应是吸热反应,B反应是放热反应 | |
| D. | A反应不需要加热,B反应必须加热 |
①残留在试管内壁上的碘,用酒精洗涤
②盛放过苯酚的试剂瓶中残留的苯酚,用酒精洗涤
③做银镜反应后残留的银,用稀氨水洗涤
④沾附在试管内壁上的油脂,用热碱液洗涤.
| A. | ①②④ | B. | ②③④ | C. | ①③④ | D. | ①②③④ |
| A. | 都由C和H两种元素组成的饱和烃 | |
| B. | 都能使酸性KMnO4溶液褪色 | |
| C. | 都能发生加成反应和取代反应 | |
| D. | 在氧气中完全燃烧后都生成CO2和H2O |
| 实验目的 | 操 作 | |
| ① | 比较水和乙醇中羟基氢的活泼性强弱 | 用金属钠分别与水和乙醇反应 |
| ② | 欲证明溶液中含有SO42- | 滴入盐酸酸化的硝酸钡溶液 |
| ③ | 欲证明溶液中含有S2- | 取少量溶液滴在醋酸铅试纸上看是否变黑 |
| ④ | 证明SO2具有漂白性 | 将SO2通入酸性KMnO4溶液中 |
| ⑤ | 比较确定铜和镁的金属活动性强弱 | 用Pt作电极电解Mg(NO3)2、Cu( NO3)2 混合液 |
| ⑥ | 确定碳和硅两元素非金属性强弱 | 测同温同浓度Na2CO3和Na2SiO3水溶液的PH |
| A. | ①⑤⑥ | B. | ②③⑤ | C. | ①④⑤ | D. | ①②③④⑤⑥ |

 .
. (任写一种).
(任写一种).